Слайд 2
Реальные газы
Для реальных газов наблюдается отклонение от закона
К.-М., кроме того, при некоторых значениях внешних параметров они
могут быть переведены в жидкое и даже твёрдое состояние
Отступление от законов идеального газа связаны с наличием межмолекулярного взаимодействия
Слайд 3
Межмолекулярное взаимодействие
Межмолекулярные силы притяжения
Поляризационные силы обусловлены несимметричностью распределения
зарядов в нейтральной в целом молекуле
Дисперсионные силы обусловлены появлением
наведённой поляризации при сближении молекул
Силы отталкивания возникают на малых расстояниях из-за взаимного перекрытия электронных оболочек молекул. Они имеют квантовую природу
Слайд 4
Межмолекулярное взаимодействие
Силы притяжения обратно пропорциональны расстоянию в 7-й
степени
Силы отталкивания возрастают экспоненциально при уменьшении расстояния
Взаимодействие молекул удобно
описывать потенциальной энергией взаимодействия U(r)
Потенциал Леннарда-Джонса:
U(r)=a1/r12-a2/r6,
где a1 и a2 - константы
Слайд 5
Межмолекулярное взаимодействие
В уравнении Ван-дер-Ваальса применяется более грубая аппроксимация
– молекулы считаются абсолютно твёрдыми шарами с диаметром d
d
является нечётко определённым параметром
Слайд 6
Уравнение Ван-дер-Ваальса
Учтём влияние сил отталкивания. Конечный объём молекул
приводит к уменьшению доступного объёма и увеличению давления по
сравнению с идеальным газом. Для одного моля запишем:
P⋅(V-b)=R⋅T,
где b – объём одного моля молекул газа
Слайд 7
Уравнение Ван-дер-Ваальса
Теперь учтём влияние сил притяжения. Оно проявляется
в появлении избыточного давления:
P+Pi=n⋅k⋅T,
где Pi – избыточное «внутреннее» давление:
Pi=,
где
Nb – число молекул в пристеночном слое, отнесённое к единице площади, f – сила, действующая со стороны объёма газа
Nb~1/V, f~1/V → Pi=a/V2,
где а - константа
Слайд 9
Уравнение Ван-дер-Ваальса
Учитывая совместное действие сил притяжения и отталкивания
получим окончательно уравнение Ван-дер-Ваальса:
(P+a/V2)⋅(V-b)=R⋅T
для ν молей:
(P+a⋅ν2/V2)⋅(V/ν-b)=R⋅T
или:
(P+a⋅ν2/V2)⋅(V-ν⋅b)=ν⋅R⋅T
Слайд 10
Другие уравнения состояния
Уравнение Дитеричи:
P⋅(V-b)=R⋅T⋅exp(-a/[R⋅T⋅V])
в пределе b
a
является полуэмпирическим. При умеренных давлениях оно лучше чем уравнение В.д.В., но зато при высоких давлениях совершенно непригодно
Слайд 11
Другие уравнения состояния
Уравнение Бертло:
(P+a/(Т⋅V2))⋅(V-b)=R⋅T
Уравнение Клаузиуса:
здесь улучшение достигается
за счёт введения третьего параметра
Слайд 12
Другие уравнения состояния
Уравнение Камерлинг-Оннеса:
P⋅V=R⋅T(1+B2(T)/V+B3(T)/V2+…),
где В2, В3, …- второй,
третий и т.д. вириальные коэффициенты
Уравнение состояния любого газа может
быть приведено к данному виду
Слайд 13
Изотермы Ван-дер-Ваальса
Уравнение В.д.В. Можно привести к виду:
P⋅V3-(R⋅T+P⋅b)⋅V2+a⋅V-a⋅b=0 (*)
это кубическое
уравнение относительно V при некоторых P и T имеет
три корня, а в некоторой области P и T – один
В критической точке, где все корни равны:
P⋅V3-(R⋅T+P⋅b)⋅V2+a⋅V-a⋅b=Рк(V-Vк)3=0
Слайд 14
Изотермы Ван-дер-Ваальса
Приравнивая коэффициенты при одинаковых степенях V, получим:
Рк⋅Vк3=a⋅b, 3Рк⋅Vк2=a,
3Рк⋅Vк=R⋅Tк+Pк⋅b
Из этих трёх уравнений можно найти:
Vк=3b, Рк=a/27b2, Тк=8a/(27R⋅b)
Отношение Kк=R⋅Tк/(Рк⋅Vк)=8/3=2,67 называется
критическим коэффициентом
Для одного моля идеального газа Kк=R⋅T/(Р⋅V)=1
Для реальных газов Kк>8/3
Слайд 15
Изотермы Ван-дер-Ваальса
Расхождение экспериментальных и теоретических значений свидетельствует о
неточности уравнения В.д.В.
Слайд 16
Изотермы реальных газов
На изотермах реальных газов нет участка
с (∂P/∂V)>0. Это неустойчивое состояние
Область D-B – жидкое состояние
с малой сжимаемостью
Область А-Е – газообразное состояние
Область L-G – двухфазное состояние жидкость-пар
Слайд 17
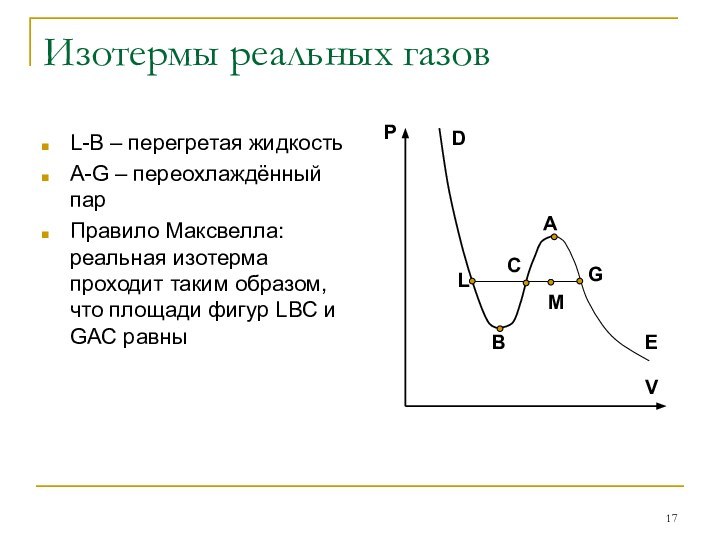
Изотермы реальных газов
L-B – перегретая жидкость
A-G – переохлаждённый
пар
Правило Максвелла: реальная изотерма проходит таким образом, что площади
фигур LBC и GAC равны
Слайд 19
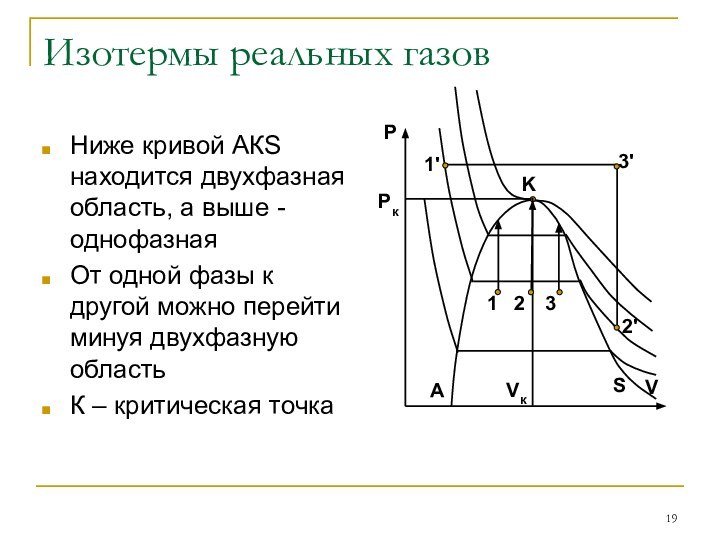
Изотермы реальных газов
Ниже кривой АКS находится двухфазная область,
а выше - однофазная
От одной фазы к другой можно
перейти минуя двухфазную область
К – критическая точка
Слайд 21
Изотермы реальных газов
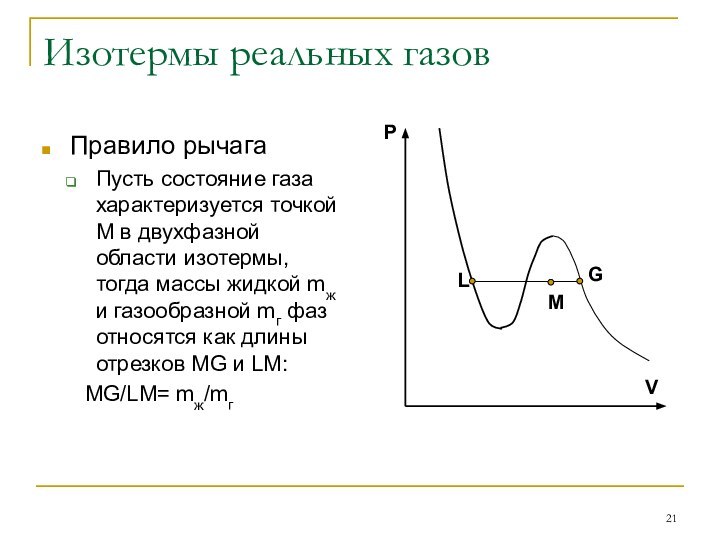
Правило рычага
Пусть состояние газа характеризуется точкой
М в двухфазной области изотермы, тогда массы жидкой mж
и газообразной mг фаз относятся как длины отрезков MG и LM:
MG/LM= mж/mг
Слайд 23
Внутренняя энергия газа В.д.В.
Для однофазных состояний:
Слайд 24
Эффект Джоуля-Томсона
Эффект Джоуля-Томсона заключается в изменении температуры газа
при его прохождении через малое отверстие (дросселировании)
Для идеального газа
эффект отсутствует
Для реального газа эффект может быть как положительным (ΔТ/ΔР>0, газ охлаждается), так и отрицательным
Слайд 25
Эффект Джоуля-Томсона
При b=0, а≠0 газ всегда охлаждается
При b≠0,
а=0 – всегда нагревается
Существует температура инверсии Ti=(27/4)ТК при которой
эффект нулевой
Выше Ti газ нагревается при дросселировании, ниже Ti газ охлаждается
Для большинства газов Ti>>комнатной температуры
Для водорода и гелия Ti<<комнатной температуры
Слайд 26
Методы получения низких температур
Испарение жидкости
Эффект Джоуля-Томсона
Адиабатическое расширение газа
Растворение
одного вещества в другом
При откачивании паров 3He можно получить
температуру 0,3 К
С помощью метода адиабатического размагничивания парамагнитных солей можно получить температуру ~10-3 К
Слайд 27
Свойства веществ при низких температурах









![Реальные газы физика Другие уравнения состоянияУравнение Дитеричи: P⋅(V-b)=R⋅T⋅exp(-a/[R⋅T⋅V]) в пределе b](/img/tmb/12/1196790/7f0130870920cc5de39733751e67a36f-720x.jpg)