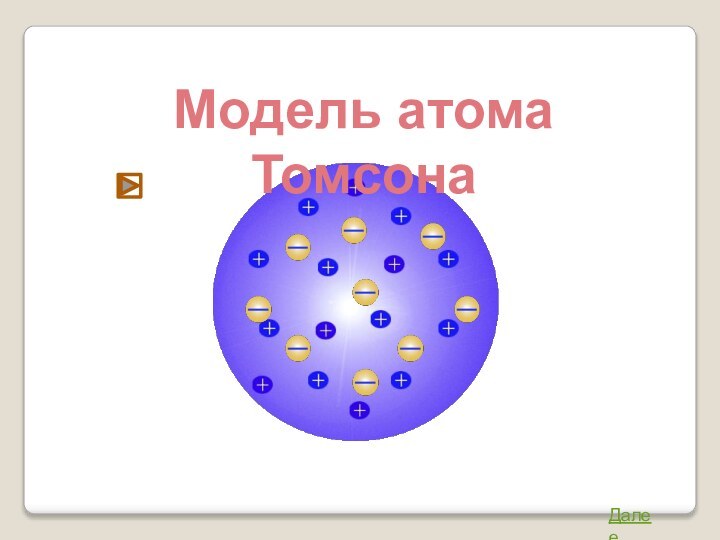
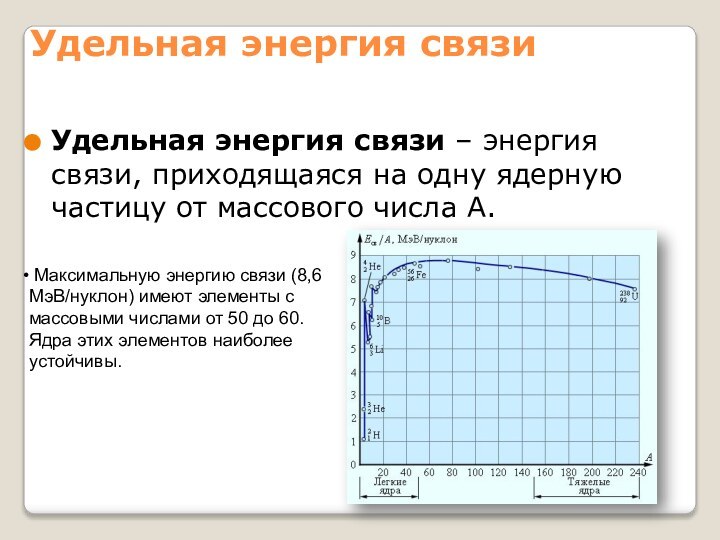
собой непрерывно заряженный положительным зарядом шар радиуса порядка 10-10м,
внутри которого около своих положений равновесия колеблются электроны.Недостатки модели:
не объясняла дискретный характер излучения атома и его устойчивость;
не дает возможности понять, что определяет размеры атомов;
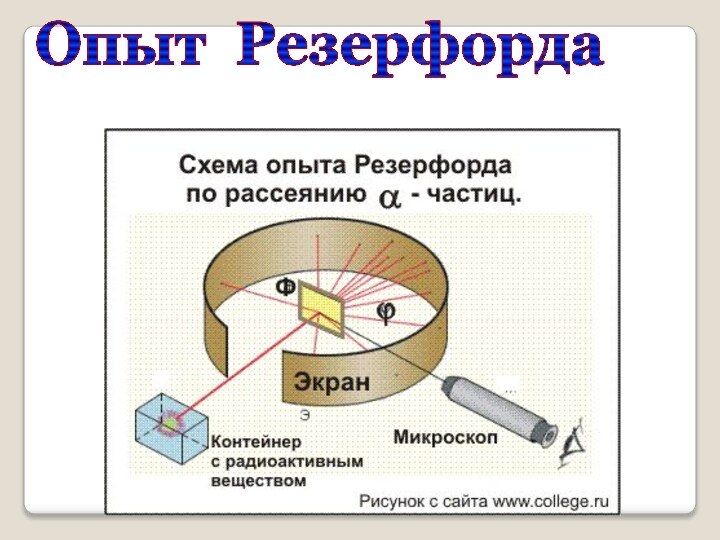
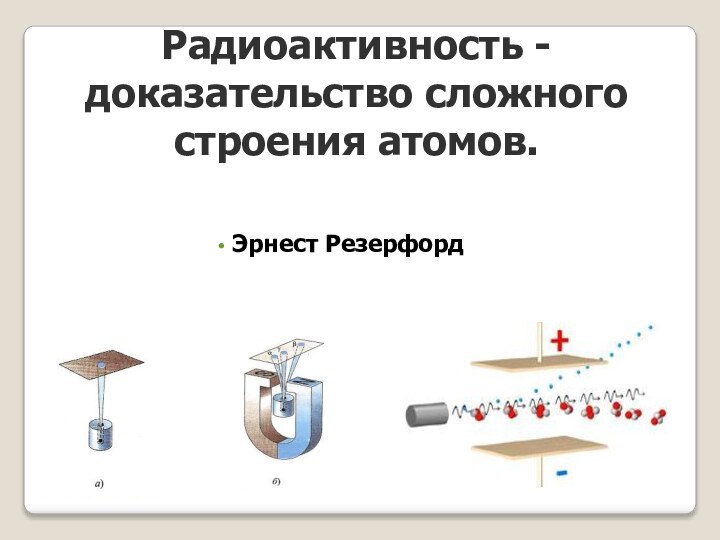
оказалась в полном противоречии с опытами по исследованию распределения положительного заряда в атоме (опыты, проводимые Эрнестом Резерфордом).