Слайд 2
Проблемный вопрос учебной темы:
Почему свинец во многом
идеален?
Цели исследования
Выяснить какими важными достоинствами обладает свинец?
Задачи
Познакомиться с литературой
и Интернет ресурсами по данной теме;
Выяснить содержание свинца в природе:
В гранитоидном слое суши;
В живом веществе;
В морской воде.
Изучить физические и химические свойства, которые лежат в основе применения свинца в промышленности;
Сделать выводы по теме.
Слайд 3
Свинец
СВИНЕЦ, Pb (plumbum), химический элемент IVА группы
периодической системы
элементов, член семейства C, Si, Ge, Sn, Pb.
Атомный
номер свинца 82
Атомная масса свинца 207,2
Изотопы свинца
стабильные 204, 206 208
нестабильные 194 203, 205, 209 214
Температура плавления, свинца С 327,500
Температура кипения свинца, С 17500
Плотность свинца, г/см3 11,34
Твердость свинца (по Моосу) 1,5
Содержание в земной коре свинца, % (масс.) 0,0016
Степени окисления свинца +2, +4
Слайд 4
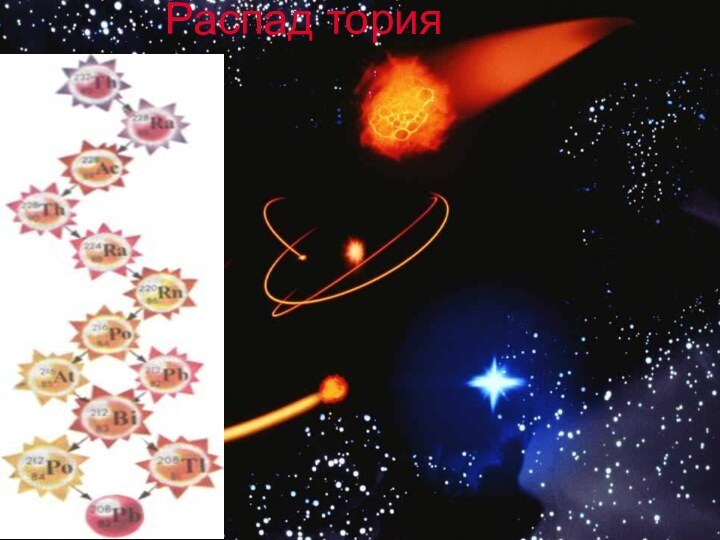
Изотопы свинца
Известно более 20 радиоактивных изотопов свинца:
206Pb(24,1%);
207Pb(22,1%); 208Pb(52,4%) – являются конечными продуктами радиоактивных превращений урана,
актиния, тория.
*Наиболее долгоживущие: 202Pb; 205Pb (период полураспада: 300тыс. и 15 млн. лет)
*Короткоживущие изотопы: 209Pb; 210Pb; 212Pb; 214Pb ( период полураспада: 3,25 и 27,1 года и 26,8 мин.)
Слайд 5
Свинец в природе.
1. Кларк свинца в земной коре
– 0,0016% по массе;
2. В гранитном слое суши –
108864*106 тонн;
3. В живом веществе – 1*10-4% (В.В. Добровольский 1983г.);
4. В морской воде – 3*10-9%
Слайд 6
Знаете ли Вы, что…?
Всего известно более 100 свинцовых
минералов.
Основные:
Галенит (свинцовый блеск) PbS;
Англезит (свинцовый купорос) PbSO4;
Церрусит («белая свинцовая
руда») PbCO3;
Реже встречаются в природе:
Пироморфит («зеленая свинцовая руда»)PbCl2*3Pb3(PO4)3
Миметит PbCl2*3Pb3(AsO4)2 ;
Крокоит («красная свинцовая руда») PbCrO4;
Вульфенит («желтая свинцовая руда) PbMoO4;
Штольцит PbWO4.
Слайд 7
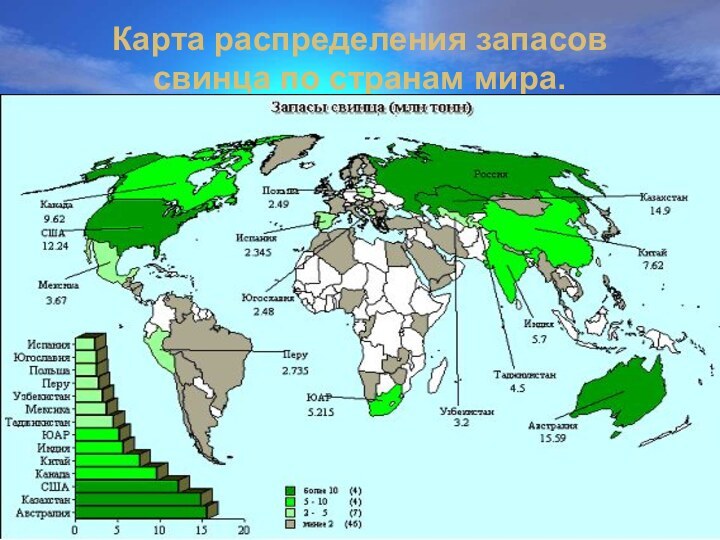
Карта распределения запасов свинца по странам мира.
Слайд 8
Наиболее крупное местораждение свинца в России (в %
от общероссийских запасов)
Слайд 9
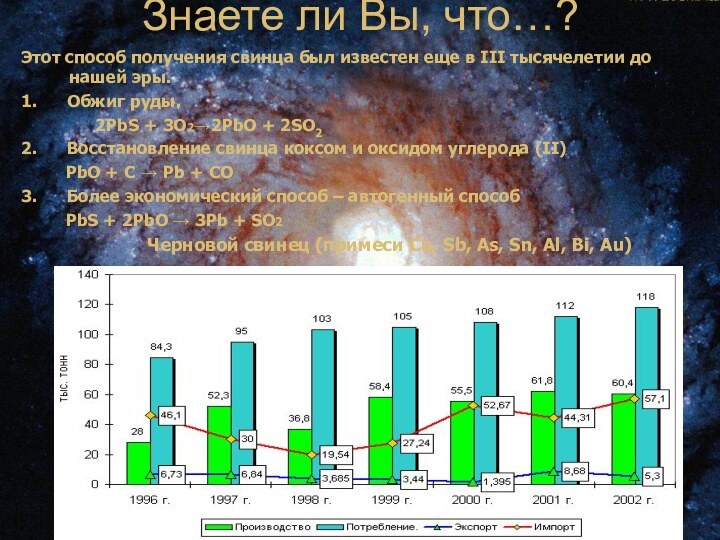
Знаете ли Вы, что…?
Этот способ получения свинца был
известен еще в III тысячелетии до нашей эры.
1.
Обжиг руды.
2PbS + 3O2→2PbO + 2SO2
2. Восстановление свинца коксом и оксидом углерода (II)
PbO + C → Pb + CО
3. Более экономический способ – автогенный способ
PbS + 2PbO → 3Pb + SO2
Черновой свинец (примеси Cu, Sb, As, Sn, Al, Bi, Au)
Слайд 10
Состав→ строение→ свойства→ применение
Свинец обычно имеет грязно-серый цвет,
легко царапается ногтем и режется ножом. свежий его разрез
имеет синеватый отлив и блестит, но быстро покрывается тускло-серой защитной пленкой PbO или основного карбоната Pb(OH)2(CO3)2 . Легко куется и прокатывается с увеличением давления.
Слайд 11
Химические свойства свинца.
Свинец – малоактивный металл.
Pb + H2O≠
2Pb
+ O2 + 2H2O=2Pb(OH)2 (в присутствии воздуха)
Pb + 4KOH
+ 2H2O=K4[Pb(OH)6] + H2
гидроксоплюмбит калия
Электрохимический ряд напряжений металлов
(ослабление восстановительных свойств, активности)
Слайд 13
Соединения свинца.
Pb(NO3)2 –
Ca2PbO4
ортоплюмбат кальция
- антикоррозийные краски (защитный слой образуется за счет отложения карбонатов)
BaPbO3
метаплюмбат бария
Pb(CH3COO)2 – 2% водный раствор примочки воспаленных участков тела, болеутоляющее
PbSO4 – для количественного определения свинца в аналитической химии
PbCrO4 – желтая минеральная краска и пигмент для масленых красок
PbS – глазурное покрытие гончарных изделий, обладает свойством полупроводимости
PbO + HCl ≠
Pb + H2SO4 ≠ образуется пленка из нерастворимой соли.
2Pb + 4CH3COOH + O2 → 2Pb(CH3COO)2 +2H2O
«свинцовый сахар»
Качественная реакция на ионы свинца:
Pb(NO3)2 + 2KJ = PbJ2 + 2KNO3
Pb 2+ + 2J - = PBJ2 (осадок желтого цвета)
Все растворы свинца ядовиты!
Слайд 14
Выводы
Свинец – это один из самых тяжелых металлов,
который распространен гораздо больше чем Au, Hg и Bi.
Это связано с тем, что разные изотопы свинца, являющимися конечным продуктом распада урана и тория, в результате чего содержание свинца в земной коре медленно увеличивалось.
Свинец – во многом идеальный металл, т.к. обладает массой важных для промышленности достоинств:
Удобный в переработке из-за низкой температуры плавления (3270С);
Незначительная прочность и высокая пластичность, легко поддается вальцовке;
Коррозийная стойкость металла;
Относительно дешевый металл (в двое дешевле Al и в одиннадцать раз Sn);
Хорошая растворимость благородных металлов в свинце;
Низкая проводимость электричества и тепла;
Способность задерживать рентгеновские лучи и гамма-излучения.