Слайд 2
ВЗРЫВ
Взрыв – процесс быстрого физического или химического превращения
системы, сопровождающийся переходом потенциальной энергии этой системы в механическую
работу.
Существенный признак взрыва – резкий скачок давления в среде, окружающей место взрыва.
Примеры физического взрыва: взрыв парового котла, баллона с газом; процессы при мощном электрическом разряде (молния).
Химический взрыв связан с превращением взрывчатых веществ (ВВ). ВВ – термодинамически неустойчивые химические системы, в которых при внешнем воздействии происходят быстрые экзотермические химические превращения с образованием сильно нагретых газов или паров.
Слайд 3
Условия взрывчатого превращения
Таким образом, способность химических систем к
взрывчатому превращению определяется тремя необходимыми и
достаточными условиями: 1) экзотермичностью
процесса, 2) большой скоростью его протекания, 3) наличием газообразных продуктов реакции
Без выделения тепла процесс не будет самоподдерживающимся.
При небольшой скорости его протекания не будет резкого скачка давления (пример – горение). Без газообразных продуктов опять же не
будет скачка давления. Пример: термитная реакция 2Al+Fe2O3=Al2O3+2Fe с выделением большого количества тепла 198 ккал на моль Fe2O3.
Слайд 4
Взрывчатые вещества. Исторический обзор
Первым ВВ, изобретенным человечеством был
черный (дымный) порох. Он появился в древние времена в
Китае, Индии, Византии (греческий огонь). В Европе порох как метательное ВВ используется с 13-го столетия после получения его в 1354г. монахом Бертольдом Шварцем (Bertold Schwarz, Freiburg, Germany), хотя некоторые источники указывают на 1242г. и первооткрывателем называют монаха Роджера Бекона. Вначале порох использовался только в военном деле, но с 1627г в Германии его начали использовать в горном деле. С помощью черного пороха, например, прокладывали штольни в шахтах.
Черный порох – смесь калиевой селитры (поташ, KNO3), серы и древесного угля.
До середины 19 века он был единственным ВВ, широко применяемым на практике, хотя в 18 веке были уже открыты другие ВВ.
Слайд 5
В 18-19-веке, появились новые мощные ВВ и средства

взрывания. Большой вклад в создание бризантных ВВ внес Альфред
Нобель, основатель Нобелевской премии. Хронология появления наиболее важных ВВ:
В 1770-1780г. А. Лавуазье и К. Бертолле изобрели бертолетовую соль (на основе хлората калия)
В 1771г. П. Вульф синтезировал пикриновую кислоту (тринитрофенол)
В 1799г Е. Говард (E. Goward) изобрел гремучую ртуть
В 1831г Бикфорд (Bickford) изобрел огнепроводный шнур
В 1846г А. Собреро (A. Sobrero) изобрел нитроглицерин
В 1863г. И. Вильбрандт получил тротил
В 1866г А. Нобель (A. Nobel) организовал производство динамита на основе нитроглицерина
В 1867г Нобель организовал производство детонаторов на основе гремучей ртути
В 1867г химики И. Ольсен (I. Olsen) и И. Норбен (I. Norben) запатентовали ВВ на основе аммиачной селитры.
В 1884г П. Вьель получил бездымный порох из пироксилина (на основе хлопковой целлюлозы). Примерно в это же время А. Нобель получил бездымный порох и назвал его баллиститом.
В 1887г К. Мартенс получил тетрил
В 1890г получен азид свица (Т. Курциус)
В 1894г синтезирован тэн (Толлен и Виган)
В 1897г синтезирован гексоген (Ленце)
В 1908г был изобретен детонатор на основе азида свинца
В 1927г был изобретен детонирующий шнур
В 1941г как побочный продукт в производстве гексогена получен октоген (Г. Райт, В. Бахман)
Взрывчатые вещества. Исторический обзор
Слайд 6
От порохов к бризантным ВВ
Химик Н.Н. Зинин и

артиллерист В.Ф. Петрушевский уже в 1850-х годах предложили применять
нитроглицерин взамен черного пороха для снаряжения мин и гранат и 1863-66г ими были проведены соответствующие эксперименты, в которых использовали почти 3 т нитроглицерина.
Особую роль в создании ВВ сыграл Альфред Нобель (1833-1896). Он создал в Европе сеть заводов по производству нитроглицерина и, затем, динамитов. Он обладатель более 350 патентов, числе которых составы динамита, гремучего студня, бездымного пороха (баллистит), прогрессивно горящего пороха (progressive burning propellant) для артиллерийских приложений и т.д.
Во многих странах, в т.ч. В СССР, с 70-х годов 19 века и до середины 20 века в качестве промышленных ВВ широко применялись динамиты.
С конца 19- начала 20 века в боеприпасах и в горных работах уже широко применялись ВВ на основе тротила, тетрила, тэна, гексогена. Например, смеси аммиачной селитры с тротилом: аммониты (для взрывных работ) и аммотолы (для снаряжения боеприпасов).
Слайд 7
Классификация ВВ
С точки зрения применения все конденсированные ВВ
делятся на 4 группы: инициирующие (первичные) ВВ; вторичные ВВ;
пороха и ракетные топлива; пиротехнические составы.
Обычно все материалы, применяющиеся при взрывных работах называют взрывчатыми материалами (ВМ). ВМ, в свою очередь подразделяются на средства взрывания (СВ) и «рабочие» взрывчатые вещества (ВВ).
Слайд 8
Индивидуальные ВВ и взрывчатые смеси
С точки зрения композиции

(состава) все ВВ подразделяются на две основные группы: (1)
взрывчатые химические соединения (индивидуальные ВВ) и (2) взрывчатые смеси (смесевые ВВ).
Большинство веществ из (1) есть кислородосодержащие органические соединения, способные к частичному или полному внутримолекулярному горению. Но есть и неустойчивые соединения без кислорода , распадающиеся на составные части с выделением энергии. Пример – азид свинца с реакцией разложения PbN6 → Pb + 3N2. Такие соединения отличаются молекулярной структурой с низкой прочностью и повышенной чувствительностью к внешним воздействиям. Например, галоидные и сернистые соединения азота (NCl3, NHI2, N4S4) .
Во взрывчатые смеси состоят по крайней мере из двух химически не связанных компонентов. Обычно один из компонентов богат кислородом, а второй - горючее вещество, либо не содержащее кислорода, либо содержащее его в малом количестве. Смеси бывают газообразные, жидкие, твердые или гетерогенные.
Слайд 9
Взрывчатые смеси
1) Жидкие смеси состоят обычно из топлива,
сгорающего с большим тепловым эффектом (бензол, толуол) и окислителя
(дымящаяся H2NO3, тетранитрометан). Жидкие смеси очень чувствительны, легко взрываются, поэтому неудобны в использовании и применяются редко.
2) Твердые взрывчатые смеси широко применяются и в военном деле и в гражданской промышленности. В зависимости от типа окислителя они подразделяются на подгруппы. Наиболее широкая группа – это аммонийно-селитренные ВВ (аммониты), содержащие аммонийную селитру NH4NO3. В качестве горючего используется нитросоединения с недостаточным до полного окисления содержанием кислорода (тротил, динитробензол).
Слайд 10
Инициирующие ВВ
Инициирующие ВВ очень чувствительны к термическому и
механическому воздействию и используются в производстве детонаторов. За счет
детонаторов производится инициирование детонации во вторичных ВВ. Обычно используются следующие инициирующие ВВ:
гремучая ртуть (фульминат ртути – Hg(ONC)2)
азид свинца - PbN6
стифнат (тринитрорезорцинат) свинца - C6H(NO2)3O2Pb·H2O
Слайд 11
Вторичные ВВ
Вторичные ВВ используют как источник энергии в
военном деле и обработке материалов взрывом. Главными компонентами промышленных
вторичных ВВ являются:
нитроглицерин (глицеринтринитрат)- C3H5(ONO2)3
тэн (пентаэритриттетранитрат) - C(CH2ONO2)4
тротил (тринитротолуол) - C6H2(NO2)3CH3
тетрил (тринитрофенилметилнитромин) - C6H2(NO2)3NCH3NO2
пикриновая кислота (тринитрофенол) – C6H2(NO2)3OH
гексоген – C3N3H6(NO2)3
октоген - C4N4H8(NO2)4
аммиачная селитра (нитрат аммония) – NH4NO3
кальциевая селитра - Ca(NO3)2
калийная селитра (поташ) – KNO3
натриевая селитра (сода)- NaNO3
Горючие добавки: дизельное топливо, древесная мука, парафин, алюминиевая пудра, микропористая резина, кизельгур и т.д.
Слайд 12
Реакции взрывчатого превращения ВВ
Для составления приближенного уравнения реакции
ВВ удобно записать его химическую формулу в виде CaHbOcNd.
В зависимости от соотношения между коэффициентами a, b и c все ВВ разобъем на три группы:
1) c ≥ (2a + b/2), тогда кислорода достаточно для полного окисления всех атомов углерода и водорода и ПД содержат в основном CO2, H2O и N2.
2) a < c < (2a + b/2), кислорода не хватает до полного окисления, ПД; кроме CO2 и H2O, содержат CO, H2 и N2. При c ≤ (a+b/2) может присутствовать углерод в виде сажи.
3) c ≤ a, В ПД всегда появляется свободный углерод.
Слайд 13
Реакции взрывчатого превращения ВВ
Группа 1, c ≥ (2a
+ b/2). Полное окисление C и H.
Группа
2, a < c < (2a + b/2). Кислород сначала окисляет С до СО, затем его остаток делится поровну между H2 и CO, окисляя их до H2O и CO2.
Группа 3, c ≤ a . Частичное окисление C и H. Наличие углерода в твердой фазе.
Уравнения применяются для предварительных, достаточно грубых, оценок теплоты взрыва и количества газов. Реальный состав ПД намного сложнее.
Слайд 14
Продукты взрыва и их токсичность
В состав промышленных ВВ,
кроме основных составляющих входят различные добавки. Кроме CO2, H2O,
CO, H2, C продукты взрыва содержат также некоторые количества (≈10-20 об.% для смесей тротила с амм. селитрой) окислов азота, углеводороды, сернистые соединения и др. Многие из них токсичны.
Двуокись азота NO2 образуется при соединении с кислородом первоначально образующейся окиси азота NO. Действует на организм со скрытым периодом 4-6 часов. Вызывает отек легких.
Окись углерода CO (угарный газ). При непродолжительном вдыхании - головная боль, тошнота , сонливость. При длительном вдыхании – потеря сознания, удушье.
Токсичность тесно связана с кислородным балансом Bk ВВ. При положительном Bk образуются окислы азота. При отрицательном – угарный газ. Поэтому в подземных условиях применяют ВВ с кислородным балансом, близким к нулю.
Слайд 15
Кислородный баланс
Кислородный баланс Bk характеризует обеспеченность ВВ кислородом,
т.е. его избыток или недостаток для полного окисления горючих
элементов до их высших окислов. Азот не окисляется. Реакция внутреннего окисления индивидуального ВВ с общей формулой CaHbOcNd при нулевом кислородном балансе:
Формула для вычисления кислородного баланса
Bk отражает излишек или недостаток кислорода по сравнению с нулевым балансом в массовых процентах. В знаменателе молекулярный вес ВВ.
Слайд 16
Соотношения между массовыми и мольными долями во взрывчатых
смесях
mi = Mi/M – массовая доля i-ой компоненты
ni =
Ni/N – мольная доля i-ой компоненты
μi – молярная масса i-ой компоненты
Слайд 17
Кислородный баланс
Иногда применяется кислородный коэффициент αk = с/(2a+b/2)
Примеры
расчета Bk.
Тротил (тринитротолуол), C6H2(NO2)3CH3 = С7H5O6N3;
μ = 227
г/моль, a=7, b=5, c=6, d=3; Bk= -74.0%
Аммонийная (аммиачная) селитра, NH4NO3=H4O3N2;
μ = 80 г/моль, a=0, b=4, c=2, d=3; Bk= +20%
Аммонит 6ЖВ (смесь по массе 19% тротила и 81% АС)
Мольные доли ТНТ и АС соответственно n1 = 0.0764, n2 = 0.9236.
0,0764 С7H5O6N3 + 0,9236 H4O3N2 = C0.5348H4.0764O3.2232N2.0764
μ = 91.1348 г/моль a=0.5348, b=4.0764, c=3.2232, d=2.0764; Bk= +0,02%
Т.е. кислородный баланс практически нулевой.
Слайд 18
Теплота взрыва
Взрыв – это своего рода тепловая машина
, в которой потенциальная химическая энергия преобразуется сначала в
теплоту, затем в механическую работу. Высвобождаемая при взрыве энергия называется теплотой взрыва. Экспериментально теплоту взрыва Qv определяют в калориметрических установках, состоящих из толстостенной стальной «бомбы» и жидкостного калориметра. Заряд помещают в бомбу, взрывают и , после установления теплового равновесия измеряют температуру жидкости. Воздух из бомбы откачивают или ее заполняют инертным газом, например, азотом. По изменению температуры системы и по известным массам и теплоемкостям бомбы и жидкости вычисляют Qv.
Т.к. пары воды при охлаждении конденсируются, из полученного значения вычисляется теплота парообразования. Массу образовавшейся воды определяют, собрав ее продувкой бомбы сухим воздухом.
Слайд 19
Теоретический способ определения теплоты взрыва основан на законе
Гесса : тепловой эффект химической реакции не зависит от
пути ее протекания, а определяется составом исходных веществ и продуктов реакции. Поэтому теплоту реакции можно вычислять как разность теплот их образования.
Тепловой эффект химической реакции, идущей при постоянном объеме равен уменьшению внутренней энергии системы Qv = -ΔE, а при постоянном давлении уменьшению ее энтальпии Qp = -ΔH. Энтальпию также называют теплосодержанием или тепловой функцией Гиббса. Энтальпия и энергия связаны формулой H = E + PV.
При детонации реакция происходит быстро, начальный объем газов равен объему заряда ВВ, потому теплота взрыва равна Qv , при этом
Qv = Qp + pΔV.
Слайд 20
Пример расчета теплоты взрыва.
Возьмем реакцию взрывного превращения
гексогена
µ = 222 г/моль = 0,222 кг/моль
Из одного моля
ВВ образуется 7,5 молей газов. Кислородный баланс Bk = - 21,6 %
Энтальпия образования H простых веществ (C, H2, O2, N2) в термодинамических расчетах считается равной нулю. Для остальных веществ имеются табличные данные. Для гексогена Hвв = - 71,6 кДж/моль, HCO2 = 395,6; HH2O = 241,9; HCO = 112.5; Отсюда энтальпия образования ПД справа в уравнении HПД = 1125 кДж (на моль ВВ). Тогда Qp = 1125 – (-71,6) = 1196,6 кДж/моль = 5390 кДж/кг. Добавив к этой величине pΔV = 75,7 кДж/кг, получим Qv = 5465,7 кДж/кг = 1301,4 ккал/кг.
Слайд 21
Инициирование взрыва. Средства взрывания.
Для начала взрывчатого превращения

некоторого количества ВВ необходимо внешнее воздействие, сообщающее ВВ некоторое
минимальное количество энергии (начальный импульс).
Инициирующие ВВ наиболее чувствительны к таким видам воздействия, как пламя, накол, удар, трение. При таких воздействиях они воспламеняются и горение быстро переходит в детонацию.
Вторичные ВВ в обычных условиях не способны детонировать от поджигания. Для инициирования детонации в них используют средства взрывания (СВ): КД, ЭД, ОШ, ДШ.
Если вторичное ВВ слишком малочувствительно, используют бустер из более чувствительного вторичного ВВ.
КД предназначен для инициирования рабочих зарядов огневым способом с помощью ОШ. Это металлическая гильза диаметрами dн = 7,05-7,20 мм, dв = 6,3-6,5 мм, длиной 48,5 – 51 мм. Содержит 1г вторичного ВВ (тетрил, гексоген, тен) и 0,18-0,2 г азида свинца или 0,5 г гремучей ртути. ОШ через отверстие d 2-2,5 мм в чашечке на дне гильзы воспламеняет первичное ВВ.
Слайд 22
Конструкция электродетонаторов
ЭД нормальной чувствительности не взрываются при
токе до 0,18 А в теч. 5 мин и
надежно взрываются при токе 1 А.
ЭД пониженной чувствительности не взрываются при токе до 1 А в теч. 5 мин и при воздействии статич. электричества напряжением до 10 кВ, надежно взрываются при токе 5 А.
Существуют ЭД мгновенного действия, короткозамедленного (задержка от 15 до 165 мс) и замедленного действия (задержка от 200 до 11600 мс).
Слайд 23
ОШ и ДШ
ОШ содержит дымный порох в кол-ве
6г на 1 м. Порох составляет сердцевину шнура d=0.6-2
мм. В шнуре ОША (А-асфальтированный) вокруг сердцевины 2-3 оплетки из х/б пряжи и наружный слой из водоизолирующей мастики. По оси проходит направляющая х/б нить. Требования к ОШ – полнота и постоянство скорости горения (0,85-1 см/с). Отрезок длиной 60 см сгорает за 60-70 с. Диаметр ОША 4,8-5,8 мм. Выпускается отрезками длиной 10м, сворачиваются в бухты.
Сердцевина ДШ наполнена кристаллическим или гранулированным тэном, через нее проходит 2 направляющие х/б нити. В ДША содержится 12 г ВВ на 1м; в ДШВ 14 г ВВ на 1м. Диаметр ДША 4,8-5,8 мм, ДШВ 5,5-6,1 мм. Скорость детонации ДШ 6,5 км/с, он безотказно взрывается от КД или ЭД.
Слайд 25
Формы превращения ВВ
1. Термическое разложение – происходит сравнительно
медленно (не взрывной процесс), скорость зависит от температуры. Практически
все ВВ склонны к термическому распаду и не должны храниться при Т выше 30о С
2. Горение – фронт химической реакции распространяется за счет теплопередачи. Скорость горения составляет от долей см до нескольких м в сек и быстро растет с ростом давления. При определенных условиях (замкнутый объем, большое количество ВВ) может перейти в детонацию. Г – характерный вид взрывчатого превращения порохов и ракетных топлив. При слабом инициировании детонация может быть не достигнута и ВВ сгорает в режиме дефлаграции, скорость которой может составлять десятки и сотни м/с.
3. Детонация – самораспространяющийся фронт химической реакции с движущимся впереди фронтом ударной волны (детонационная волна). Скорость ДВ составляет километры в сек. Инициирование химической реакции происходит за счет ударного сжатия исходного вещества.
Слайд 26
Детонация двухслойного заряда ВВ
Сверху слой гексогена: h =
5 мм; D = 6.3 км/с.
Снизу слой аммонита: h
= 25 мм; D = 4.0 км/с.
Угол падения ДВ на подложку ≈ 30 град.
Слайд 27
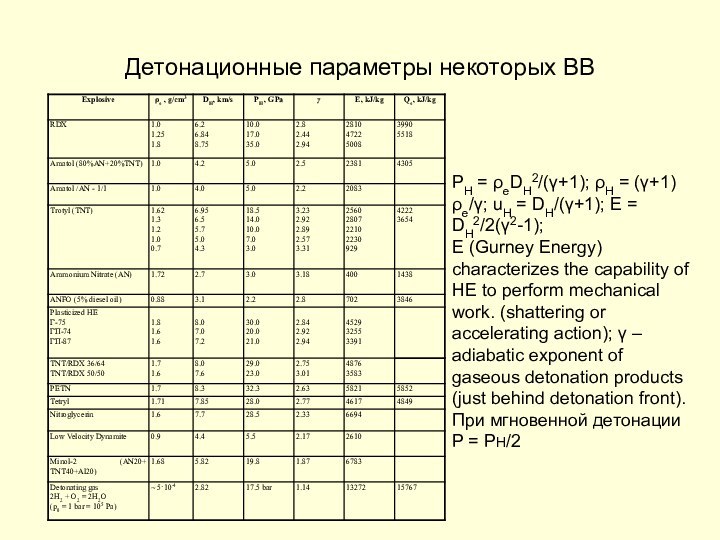
Детонационные параметры некоторых ВВ
ΡH = ρeDH2/(γ+1); ρH =
(γ+1)ρe/γ; uH = DH/(γ+1); E = DH2/2(γ2-1);
E (Gurney Energy)
characterizes the capability of HE to perform mechanical work. (shattering or accelerating action); γ – adiabatic exponent of gaseous detonation products (just behind detonation front).
При мгновенной детонации P = PH/2
Слайд 28
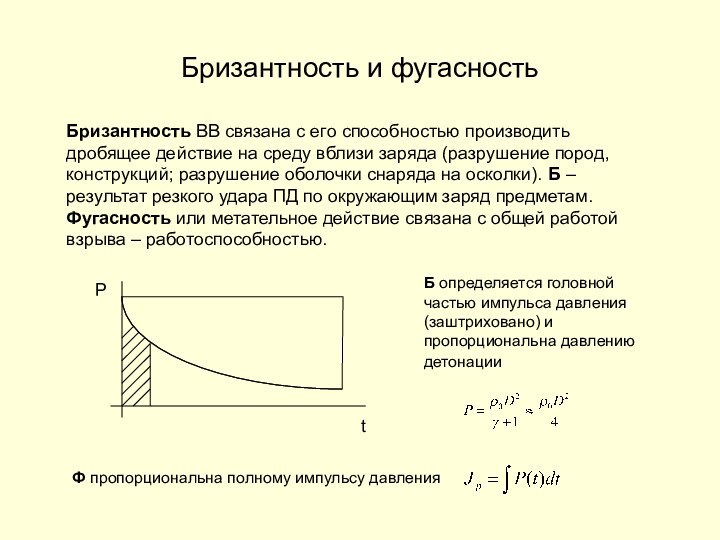
Бризантность и фугасность
Бризантность ВВ связана с его способностью
производить дробящее действие на среду вблизи заряда (разрушение пород,
конструкций; разрушение оболочки снаряда на осколки). Б –результат резкого удара ПД по окружающим заряд предметам. Фугасность или метательное действие связана с общей работой взрыва – работоспособностью.
Слайд 29
Работоспособность ВВ
Работоспособность зависит не только от теплоты взрыва,
но и от количества образующихся газов. Идеальную работоспособность можно
оценить по формуле
k= 1.3 (для 3-хатомных молекул);
V0 – начальный объем ВВ; Vp – объем газов при нормальных условиях
Пример: для гексогена на 222 г образуется 7,5 молей газов. При плотности гексогена 1 г/см3 V0 = 222 см3/моль = 0,222 л/моль. Объем газов Vp = 22.4·7,5 = 168 л/моль. Тогда A/Qv = 0.863.
Для аммиачно-селитренных ВВ кпд лежит в диапазоне 0,7-0,9.
Слайд 30
Измерения параметров ВВ
Скорость детонации обычно измеряется электроконтактным методом
или с помощью высокоскоростной оптической регистрации. В полигонных условиях
для быстрой оценки D используют метод Дотриша с применением детонирующего шнура, со скоростью детонации 6,5 км/с.
Для определения сравнительной работоспособности применяют метод свинцовой бомбы (проба Трауцля), метод баллистического маятника, метод баллистической мортиры, в полигонных условиях по воронке выброса.
Сравнительную бризантность ВВ определяют обжатием свинцовых столбиков (проба Гесса), с применением баллистического маятника (заряд устанавливают прямо на торец маятника), методом дробления кубика из горной породы (заряд 20 г, размер кубика 15х15х15 см, определяется суммарный выход дробленой фракции размером 5-7 мм).
Слайд 31
Тротиловый эквивалент
Для сравнительных оценок взрывчатой способности различных ВВ
их сравнивают с тротилом. За эталон принято брать тротил
с плотностью 1 г/см3 (порошкообразный) и теплотой взрыва 1000 ккал/кг.
Тротиловый эквивалент есть отношение работоспособности ВВ к работоспособности тротила
Другое определение ТЭ – отношение массы тротила к массе ВВ, обладающих равной работоспособностью
Слайд 32
Закон подобия для взрывных (ударных) волн
Иногда ТЭ по
отношению к некоторой массе ВВ me определяют как массу
тротила mT, создающую УВ той же интенсивности, что и me.
Экспериментально ТЭ определяют путем измерения параметров УВ в воздухе. Теоретически параметры УВ рассчитываются на основе закона подобия взрывных волн: при взрыве заряда сферической формы параметры УВ являются функциями только массы ВВ или ее энергетического эквивалента и расстояния от геометрического центра взрыва. Закон подобия вытекает из теории точечного взрыва, согласно которой энергия выделяется в точке и мгновенно, УВ распространяется без диссипативных потерь и ее параметры меняются за счет увеличения поверхности.
Слайд 33
Параметры УВ в воздухе
Избыточное давление
Импульс избыточного давления
Поток
энергии на ед. поверхности
Слайд 34
ЛИТЕРАТУРА
Росинский Н.Л., Магойченков М.А., Галаджий Ф.М. Мастер-взрывник. М.:
Недра, 1988.
2. Л.В. Дубнов, Н.С. Бахаревич, А.И. Романов. Промышленные
взрывчатые вещества – 3-е изд., перераб. и дополн. М.: Недра, 1988.
3. Ф.А.Баум, Л.П. Орленко, К.П. Станюкович и др. Физика взрыва, монография под ред. К.П. Станюковича, изд. 2-е, перераб. М.: Наука, 1975
4. Дерибас А.А. Физика упрочнения и сварки взрывом. Новосибирск: Наука, 1980.
5. De Carli P.S., Meyers M.A. Design of Uniaxial Strain Shock Recovery Experiments // Proceed. Int. Conf. “Shock Waves and High-Strain-Rate Phenomena in Metals”, Albuquerque, NM, 1980. New York: Plenum Press, 1980. P. 341-373.
6. Поздняков З.Г., Росси Б.Д. Справочник по промышленным взрывчатым веществам и средствам взрывания. М.: Недра, 1977.
5. Meyers M.A., Wang S.L. An Improved Method for Shock Consolidation of Powders // Acta Metall. 1988. Vol. 36, No. 4. P. 925-936.