- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку на тему Ток в жидкостях
Содержание
- 2. ПЛАН ОПИСАНИЯ:Свободные зарядыКак создаются свободные заряды?Вид проводимостиФормулы и законыВАХПрименение
- 3. Дистиллированная вода не проводит электрический ток. Если
- 4. ТОК В ЖИДКОСТЯХЖИДКОСТИЭЛЕКТРОЛИТЫДИЭЛЕКТРИКИПРОВОДЯТ ТОКНЕ ПРОВОДЯТ ТОКРАСТВОРЫСОЛЕЙКИСЛОТЩЕЛОЧЕЙДИСТИЛЛИРОВАННАЯВОДА
- 5. Особенность воды: Вода – диполь – молекула,
- 6. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ МЕХАНИЗМ: на примере Н2О
- 7. Электролитическая диссоциация поваренной солиNaCl → Na+ +
- 8. ВЫВОДСвободные заряды в электролитах+ и - ионыКак создаются?ЭлектролитическаядиссоциацияВид проводимостиионная
- 9. ВАХ жидкостей:А: Y=0 – тока нет, так
- 10. Как проходит ток через электролит? Опустим в
- 11. Под действием сил электрического поля положительно заряженные
- 12. CuSO4 → Cu 2+ + SO42-++-
- 13. На аноде:+ (анод)-- Сульфат - ионы SO42-
- 14. ЭЛЕКТРОЛИЗCuCl2 Cu+2+
- 15. ЭЛЕКТРОЛИЗОПРЕДЕЛЕНИЕЭЛЕКТРОЛИЗ – ЭТО ВЫДЕЛЕНИЕ ЧИСТОГО ВЕЩЕСТВА ИЗ
- 17. Исследовал электролиз и открыл его законы
- 18. ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА
- 19. Применение электролиза I Химическая промышленность: Получение галогенов,
- 20. 1.Гальваностегия – это… декоративное или антикоррозийное
- 21. Установка для электрохимического покрытия предметов слоем металла
- 22. Процесс никелирования
- 23. Цель гальваностегии- :придать предметам определенные свойства- повышенную
- 24. Отрасли промышленности в которых используется гальваностегия:Автомобилестроение;Авиастроение;Радиотехника;Электротехника;Пищевая промышленность(производство упаковок)
- 25. 2.Гальванопластика – это… электролитическоеизготовление металлических копий, рельефныхпредметов.
- 26. Основателем гальванотехники является Б. С. Якоби, изобрел
- 27. 3.Электрометаллургия – это…получение чистых металлов (Al, Na, Mg, Be) при электролизе расплавленных руд.
- 28. Скачать презентацию
- 29. Похожие презентации





















Слайд 2
ПЛАН ОПИСАНИЯ:
Свободные заряды
Как создаются свободные заряды?
Вид проводимости
Формулы и
законы
Слайд 3
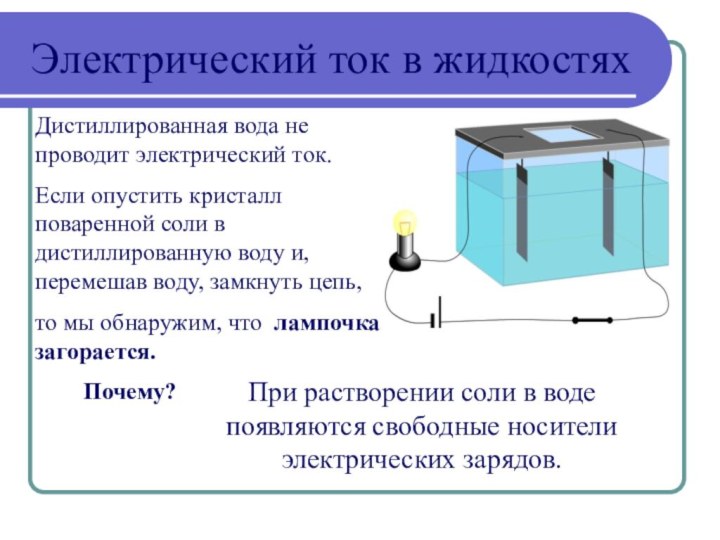
Дистиллированная вода не проводит электрический ток.
Если опустить
кристалл поваренной соли в дистиллированную воду и, перемешав воду,
замкнуть цепь,то мы обнаружим, что лампочка загорается.
Почему?
При растворении соли в воде появляются свободные носители электрических зарядов.
Электрический ток в жидкостях
Слайд 4
ТОК В ЖИДКОСТЯХ
ЖИДКОСТИ
ЭЛЕКТРОЛИТЫ
ДИЭЛЕКТРИКИ
ПРОВОДЯТ ТОК
НЕ ПРОВОДЯТ ТОК
РАСТВОРЫ
СОЛЕЙ
КИСЛОТ
ЩЕЛОЧЕЙ
ДИСТИЛЛИРОВАННАЯ
ВОДА
Слайд 5
Особенность воды:
Вода – диполь – молекула, у
которой
+ и – заряды разделены (напоминает пальчиковую батарейку).
- +
Слайд 6
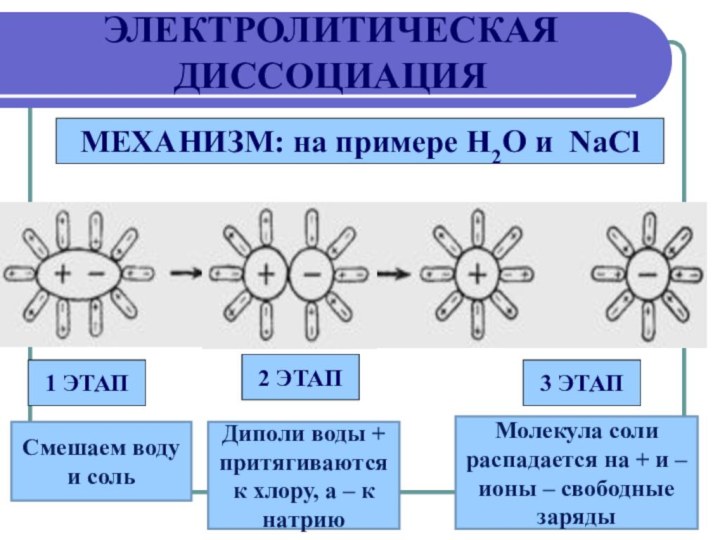
ЭЛЕКТРОЛИТИЧЕСКАЯ
ДИССОЦИАЦИЯ
МЕХАНИЗМ: на примере Н2О и NaCl
1 ЭТАП
2
ЭТАП
3 ЭТАП
Смешаем воду и соль
Диполи воды + притягиваются к
хлору, а – к натриюМолекула соли распадается на + и – ионы – свободные заряды
Слайд 7
Электролитическая диссоциация
поваренной соли
NaCl → Na+ + Cl-
Диссоциация других веществ:
CuSO4 → Cu 2+ + SO42-
H2SO4 →
H+ + H+ + SO42-CaCl2 → Ca 2+ + Cl- + Cl-
Слайд 8
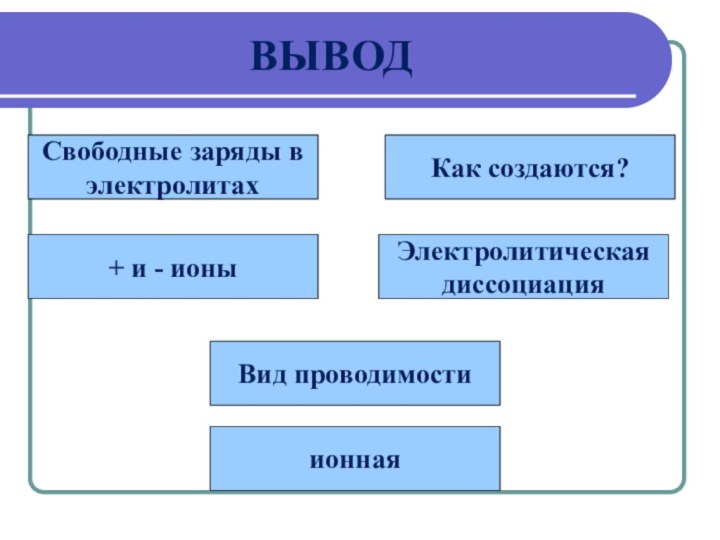
ВЫВОД
Свободные заряды в
электролитах
+ и - ионы
Как создаются?
Электролитическая
диссоциация
Вид
проводимости
ионная
Слайд 9
ВАХ жидкостей:
А: Y=0 – тока нет, так как
не началась еще диссоциация
В: Y и U возрастают, так
как число ионов увеличиваетсяА
В
Слайд 10
Как проходит ток через электролит?
Опустим в сосуд
электроды и соединим их с источником тока.
Электроды:
Катод
-пластина, соединенная с отрицательным полюсом источника.Анод - пластина, соединенная с положительным полюсом источника.
Слайд 11
Под действием сил электрического поля положительно заряженные ионы
движутся к катоду, а отрицательные ионы к аноду.
На аноде отрицательные ионы отдают свои лишние электроны, а на катоде положительные ионы получают недостающие электроны.
Слайд 12
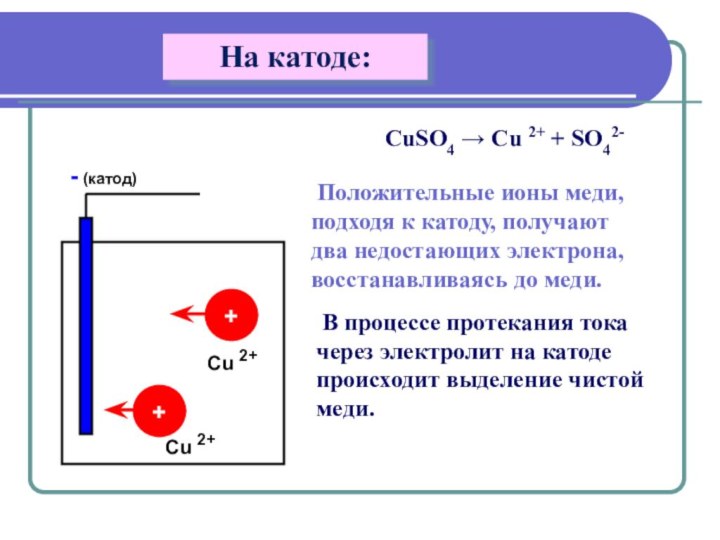
CuSO4 → Cu 2+ + SO42-
+
+
- (катод)
Положительные ионы меди, подходя к катоду, получают два недостающих
электрона, восстанавливаясь до меди. В процессе протекания тока через электролит на катоде происходит выделение чистой меди.
На катоде:
Cu 2+
Cu 2+
Слайд 13
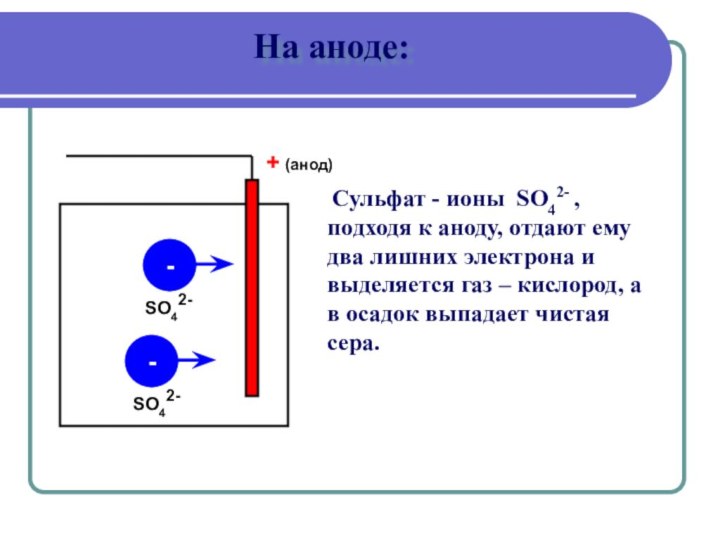
На аноде:
+ (анод)
-
-
Сульфат - ионы SO42- ,
подходя к аноду, отдают ему два лишних электрона и
выделяется газ – кислород, а в осадок выпадает чистая сера.SO42-
SO42-
Слайд 14
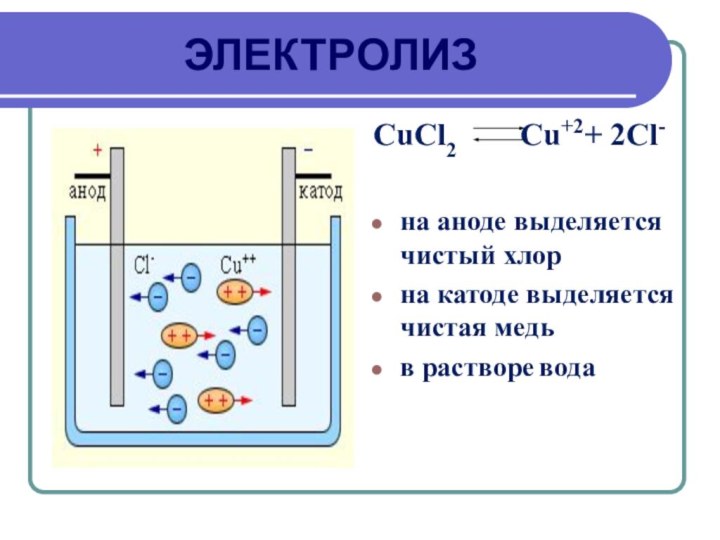
ЭЛЕКТРОЛИЗ
CuCl2 Cu+2+ 2Cl-
на
аноде выделяется чистый хлор
на катоде выделяется чистая медь
в
растворе вода
Слайд 15
ЭЛЕКТРОЛИЗ
ОПРЕДЕЛЕНИЕ
ЭЛЕКТРОЛИЗ – ЭТО ВЫДЕЛЕНИЕ
ЧИСТОГО ВЕЩЕСТВА ИЗ РАСТВОРА
ЭЛЕКТРОЛИТА ПОД ДЕЙСТВИЕМ ТОКА
ПРИМЕР
H2SO4 2H++ SO4 -2
Слайд 17 Исследовал электролиз и открыл его законы английский
физик Майкл Фарадей в 1834 году
Масса вещества, выделившегося
на электродах при электролизе, прямо пропорциональна величине тока, прошедшего через электролит за время tЗакон Фарадея.
ПОЗВОЛЯЕТ НАЙТИ МАССУ ЧИСТОГО ВЕЩЕСТВА, ВЫДЕЛЕННОГО ПРИ ЭЛЕКТРОЛИЗЕ:
m – масса чистого вещества
k – электрохимический эквивалент вещества
[ k ] = [ кг / Кл ]
Слайд 19
Применение электролиза
I Химическая промышленность:
Получение галогенов, водорода:
Получение
щелочей:
II Металлургия:
Получение щелочных и щелочноземельных металлов
Получение малоактивных металлов (алюминия)
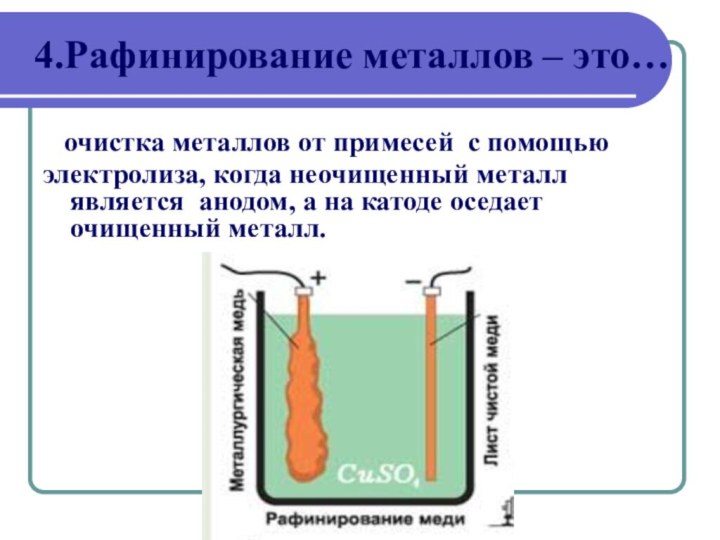
Очистка
металлов от примесей (рафинирование)III Гальванотехника:
Гальванопластика
Гальваностегия
Слайд 20
1.Гальваностегия – это…
декоративное или
антикоррозийное
покрытие
металлических
изделий тонким слоем
другого металла
(никелирование,
хромирование,
омеднение, золочение,
серебрение).





























