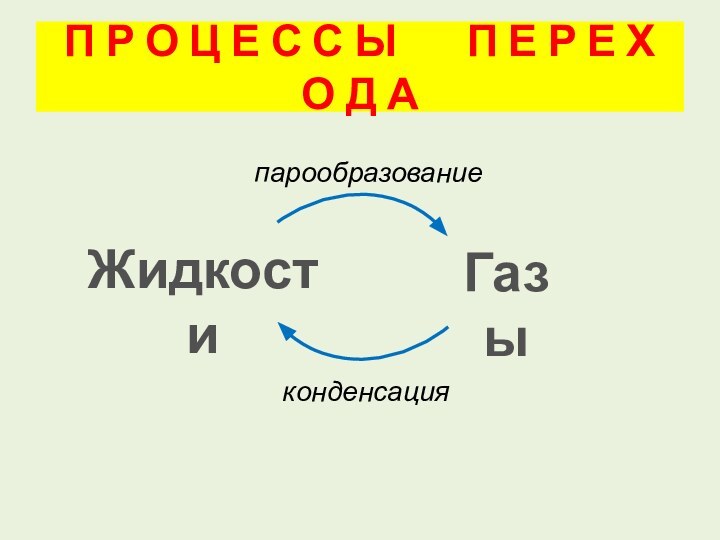
Р О Ц Е С С Ы
П Е Р Е Х О Д АЖидкости
Газы
парообразование
конденсация
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

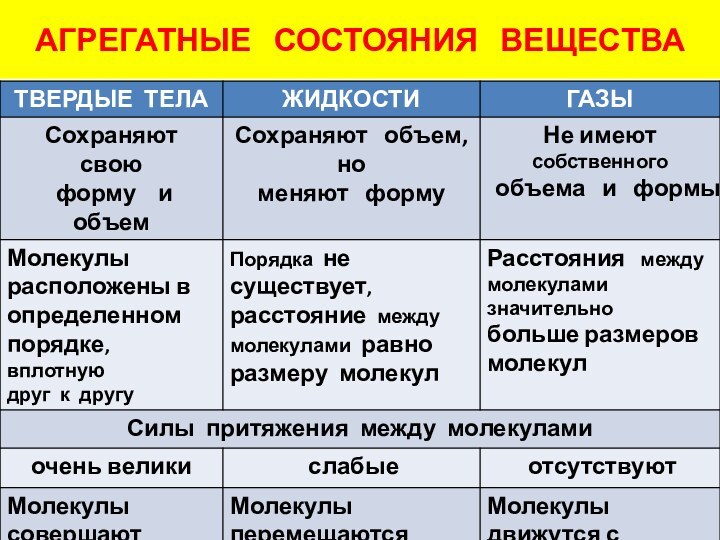





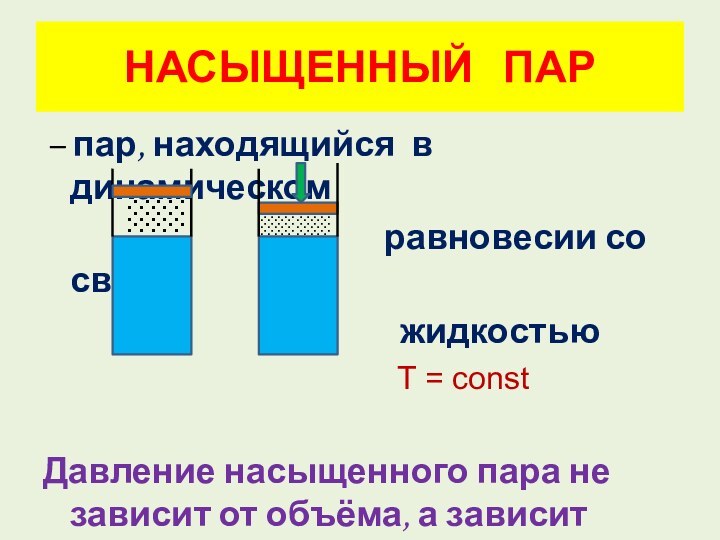







░
░
░
•
•
•
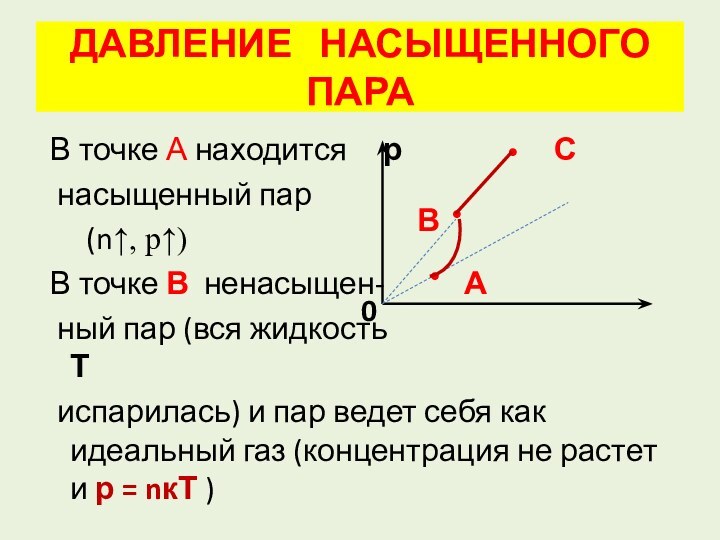
В
0
ИТОГ УРОКА