- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Законы газов
Содержание
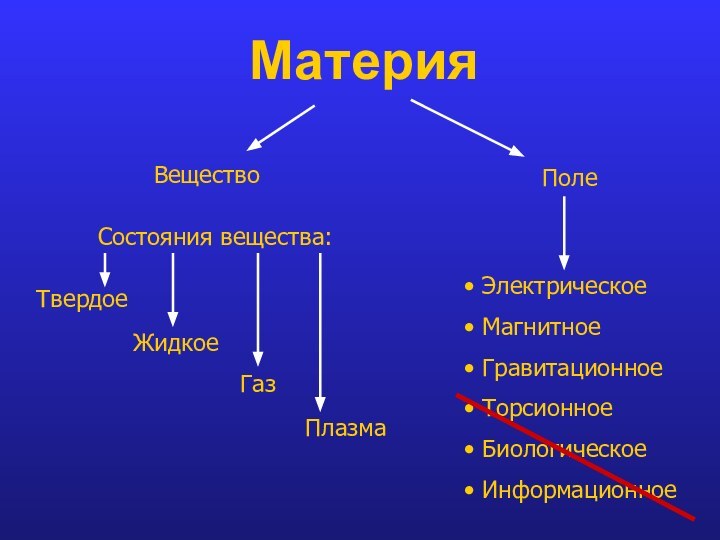
- 3. Материя ВеществоПолеСостояния вещества:ТвердоеЖидкоеГазПлазма Электрическое Магнитное Гравитационное Торсионное Биологическое Информационное
- 4. «Первичные» физические величины Масса
- 5. Производные физические величины Скорость
- 6. Единицы давления Па = Н/м2 см Н2О
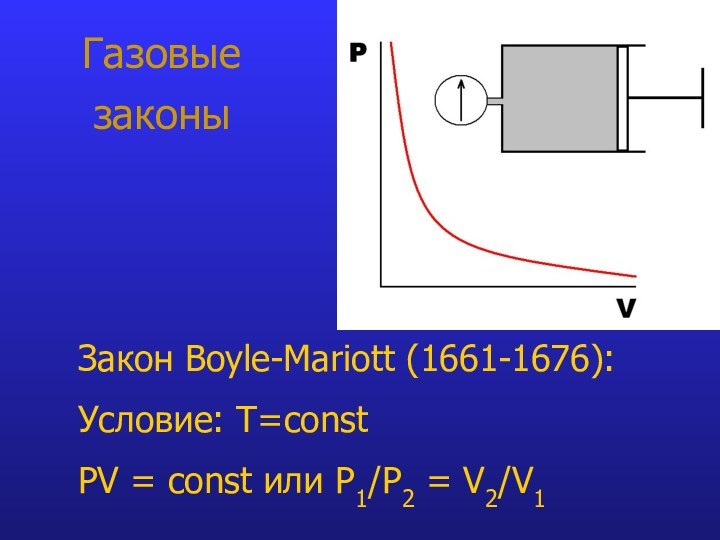
- 7. Газовые законыЗакон Boyle-Mariott (1661-1676): Условие: T=const PV = const или P1/P2 = V2/V1
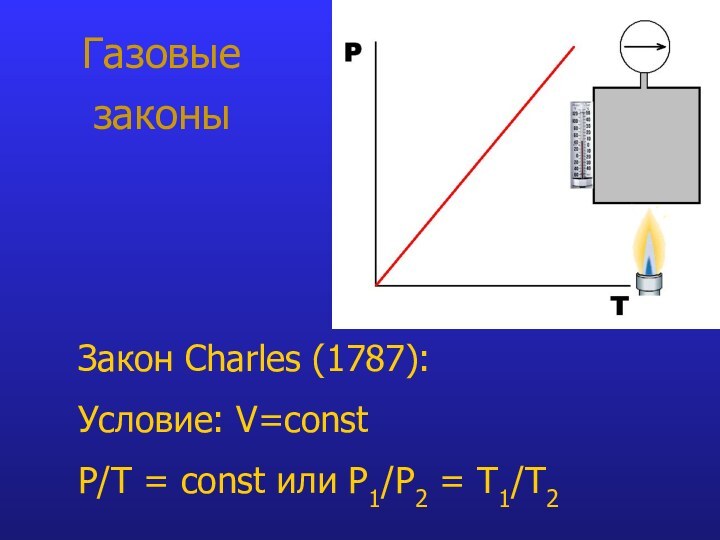
- 8. Газовые законыЗакон Charles (1787): Условие: V=const P/T = const или P1/Р2 = T1/Т2
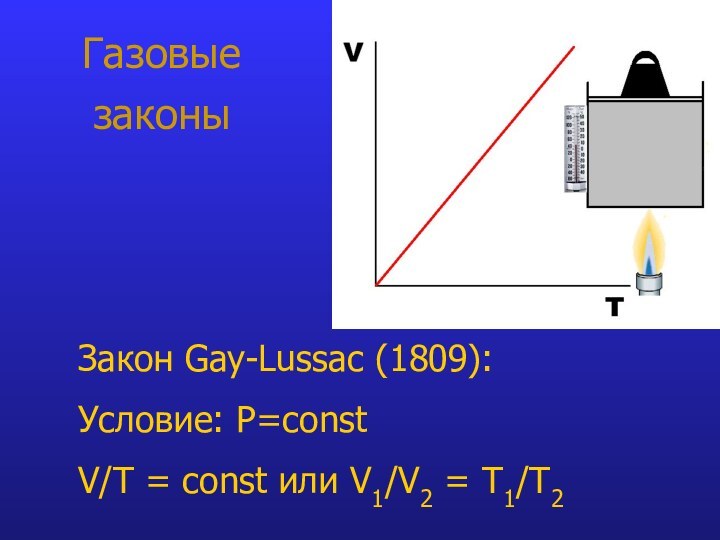
- 9. Газовые законыЗакон Gay-Lussac (1809): Условие: P=const V/T = const или V1/V2 = T1/Т2
- 10. Закон Boyle-Mariott: при
- 11. Критическая температура:Газ можно перевести в жидкое состояние
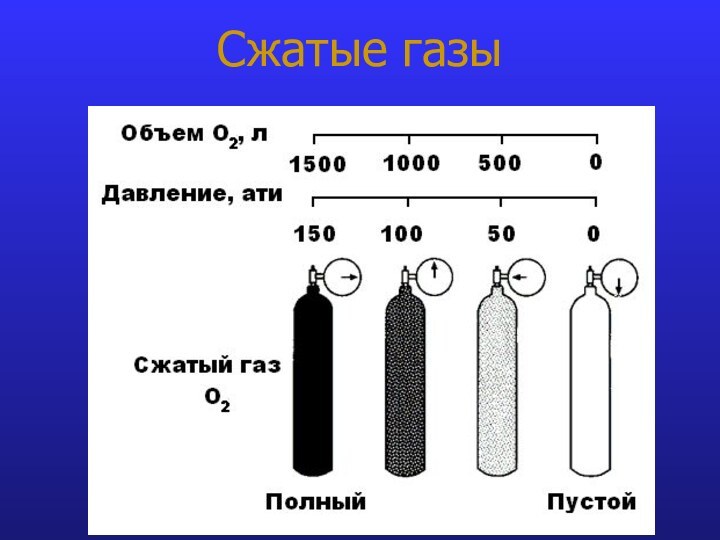
- 12. Сжатые газы
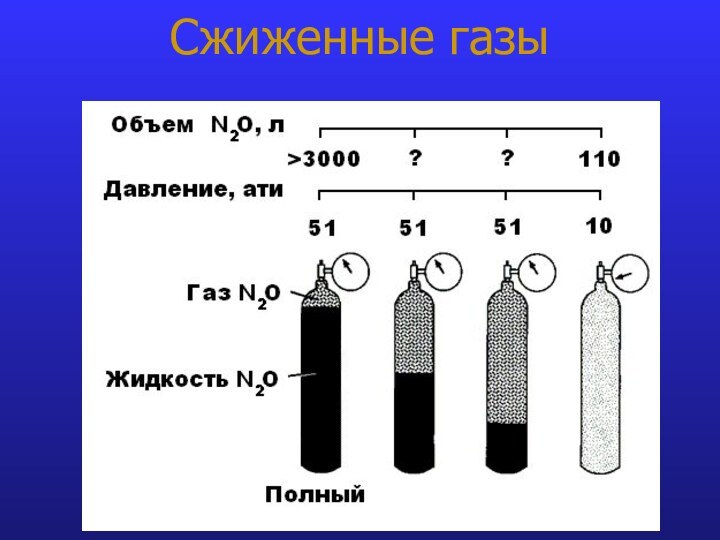
- 13. Сжиженные газы
- 14. ИСТОЧНИКИ КИСЛОРОДА Баллоны с редукторами Центральные станции
- 15. Парциальное (частичное) давление - давление, которое оказывал
- 16. Закон Avogadro (1811, «молекулярная гипотеза»):1 моль (61023
- 17. Цветовая кодировка газов!
- 18. Предохранительные клапаны и редукторыFrom: Bowie E, Huffman
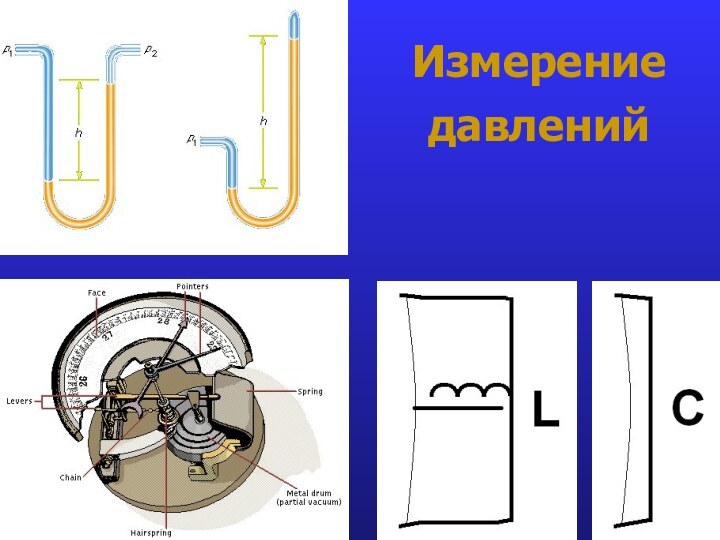
- 19. Измерение давлений
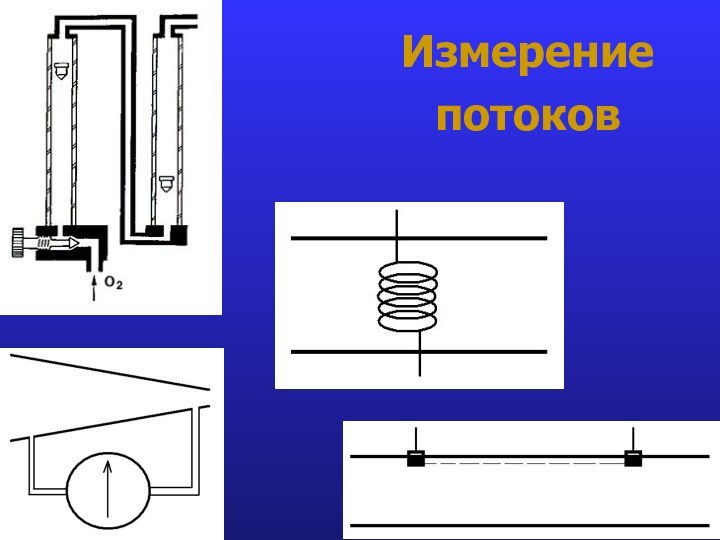
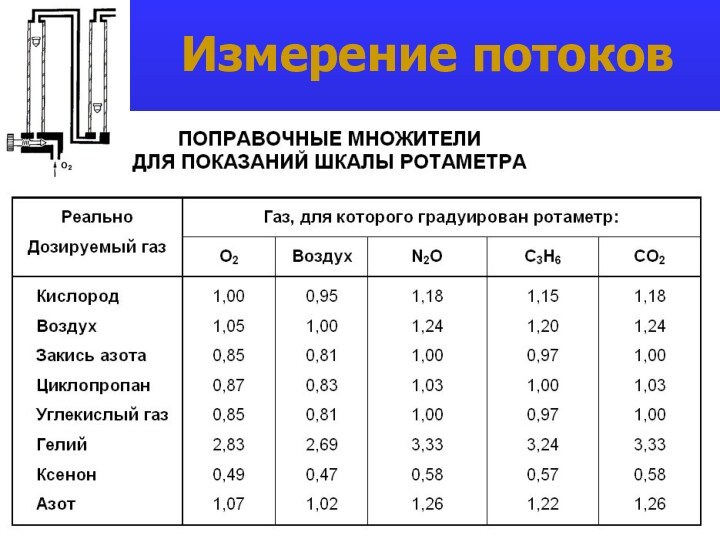
- 20. Измерение потоков
- 21. Измерение потоков
- 22. Измерение объемовV = Q(t)dt
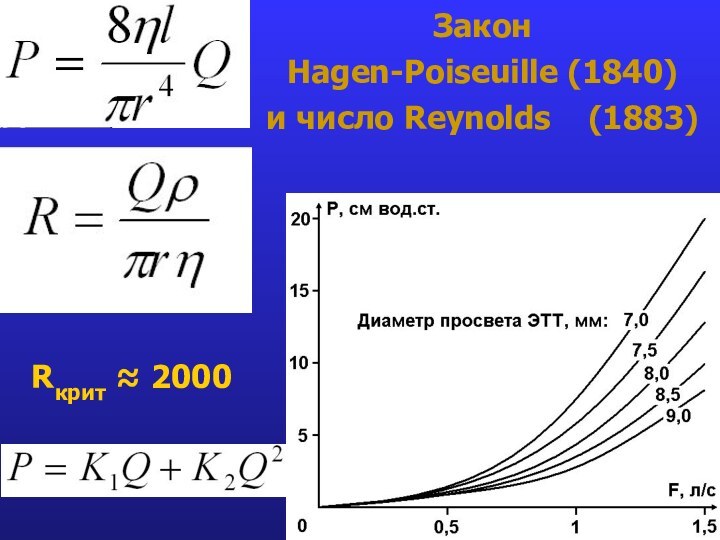
- 23. Закон Hagen-Poiseuille (1840) и число Reynolds (1883)Rкрит 2000
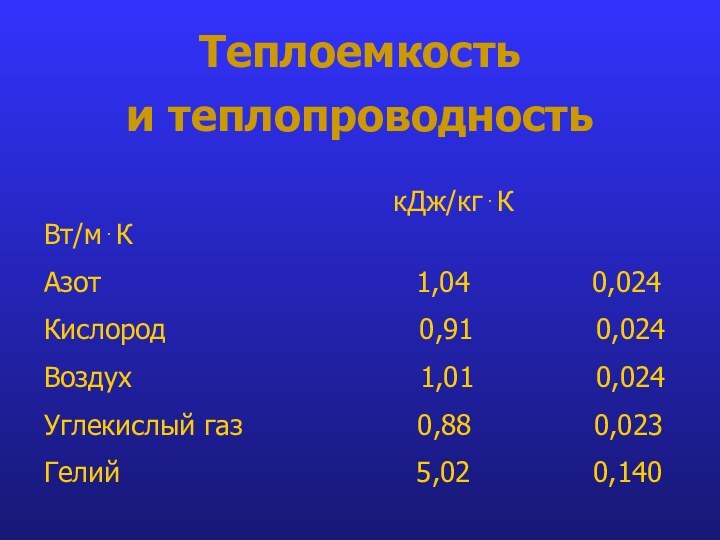
- 24. Теплоемкость и теплопроводность
- 25. Скачать презентацию
- 26. Похожие презентации
Материя ВеществоПолеСостояния вещества:ТвердоеЖидкоеГазПлазма Электрическое Магнитное Гравитационное Торсионное Биологическое Информационное











Слайд 3
Материя
Вещество
Поле
Состояния вещества:
Твердое
Жидкое
Газ
Плазма
Электрическое
Магнитное
Гравитационное
Торсионное
Биологическое
Информационное
Слайд 5
Производные физические величины
Скорость v
Lt-1 м/с
Ускорение a Lt-2 м/с2
Сила F MLt-2 Н = кгм/с2
Давление P ML-1t-2 Па = Н/м2
Слайд 6
Единицы давления
Па = Н/м2
см Н2О
100 Па = 0,1 кПа = 1 гПа
ат, атм, ата, ати - ?ата 10 м Н2О 100.000 Па = бар
мбар = 100 Па 1 см Н2О
ати = ата - 1
мм Hg = torr = 133,3 Па
Слайд 7
Газовые
законы
Закон Boyle-Mariott (1661-1676):
Условие: T=const
PV =
const или P1/P2 = V2/V1
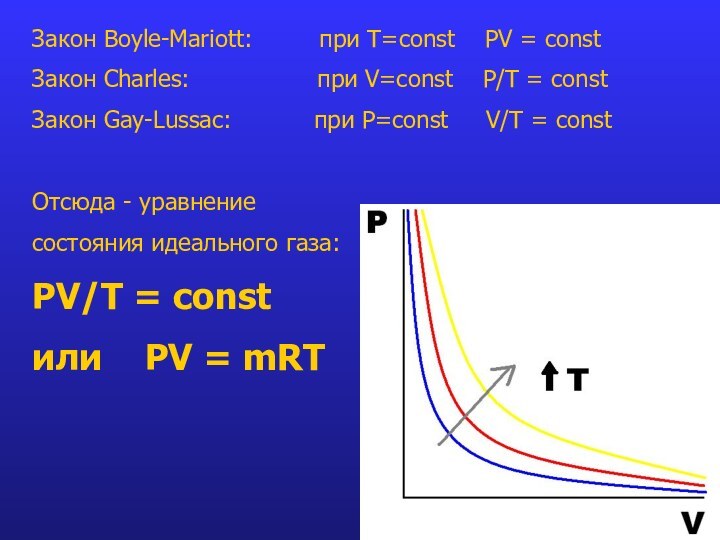
Слайд 10 Закон Boyle-Mariott: при T=const
PV = const
Закон Charles:
при V=const P/Т = constЗакон Gay-Lussac: при P=const V/T = const
Отсюда - уравнение
состояния идеального газа:
PV/T = const
или PV = mRT
Слайд 11
Критическая температура:
Газ можно перевести в жидкое состояние путем
сжатия только при температуре ниже критической (точка перегиба изотермы
на диаграмме объем-давление). Критической температуре соответствуют критическое давление, выше которого жидкость и газ сосуществуют в равновесии, и критический объем.Значения tкрит, С:
Гелий -268 Углекислый газ 31
Кислород -118 Закись азота 36
Азот -147 Ксенон 17
Слайд 14
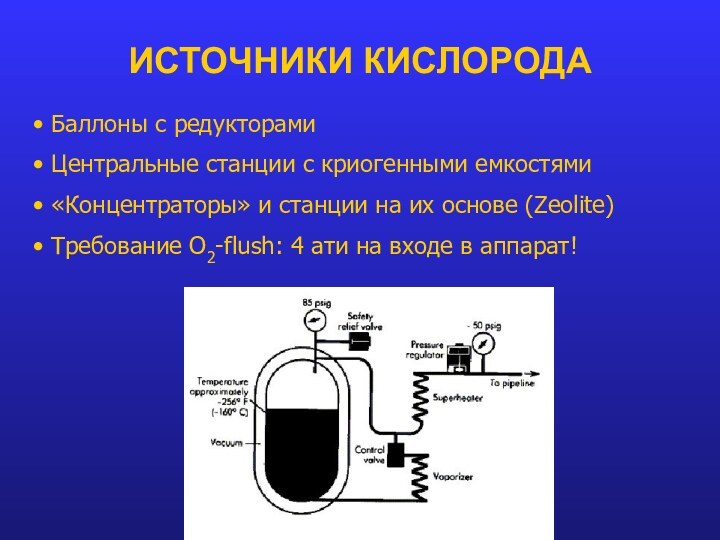
ИСТОЧНИКИ КИСЛОРОДА
Баллоны с редукторами
Центральные станции с
криогенными емкостями
«Концентраторы» и станции на их основе (Zeolite)
Требование O2-flush: 4 ати на входе в аппарат!Слайд 15 Парциальное (частичное) давление - давление, которое оказывал бы
каждый газ в отдельности в том случае, если бы
он целиком занимал весь объем, предоставленный смеси газов. Отражая количество молекул газа в объеме и их кинетическую энергию, зависит от доли газа (%) в смеси и от давления смеси как целого: PX = %XPсмеси Закон Dalton (1801): давление смеси газов равно сумме парциальных давлений компонентов
Слайд 16
Закон Avogadro (1811, «молекулярная гипотеза»):
1 моль (61023 молекул)
любого газа
при одинаковых t и Р занимает одинаковый
объем – 22,4 лМолярная масса (г/моль) численно равна ОММ (у.е.):
Гелий 4 Углекислый газ 44
Кислород 32 Закись азота 44
Азот 28 Ксенон 131
Слайд 18
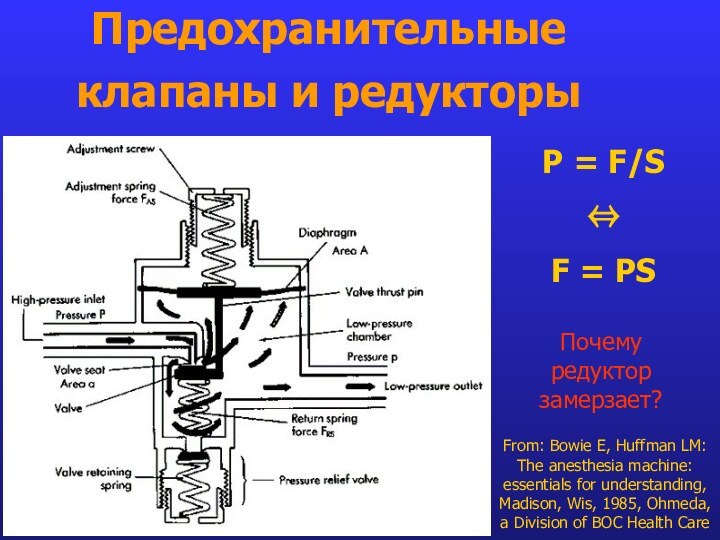
Предохранительные клапаны и редукторы
From: Bowie E, Huffman LM:
The anesthesia machine: essentials for understanding, Madison, Wis, 1985,
Ohmeda, a Division of BOC Health CareP = F/S
F = PS
Почему редуктор замерзает?
Слайд 24
Теплоемкость
и теплопроводность
кДж/кгК Вт/мК
Азот 1,04 0,024
Кислород 0,91 0,024
Воздух 1,01 0,024
Углекислый газ 0,88 0,023
Гелий 5,02 0,140





























