- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Исходная презентация Подгруппа железа для подготовки урока химии на повышенном уровне
Содержание
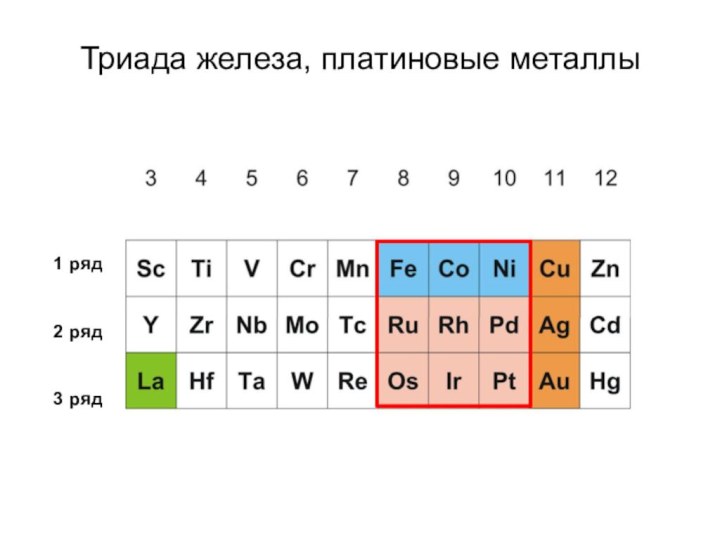
- 2. рядрядрядТриада железа, платиновые металлы
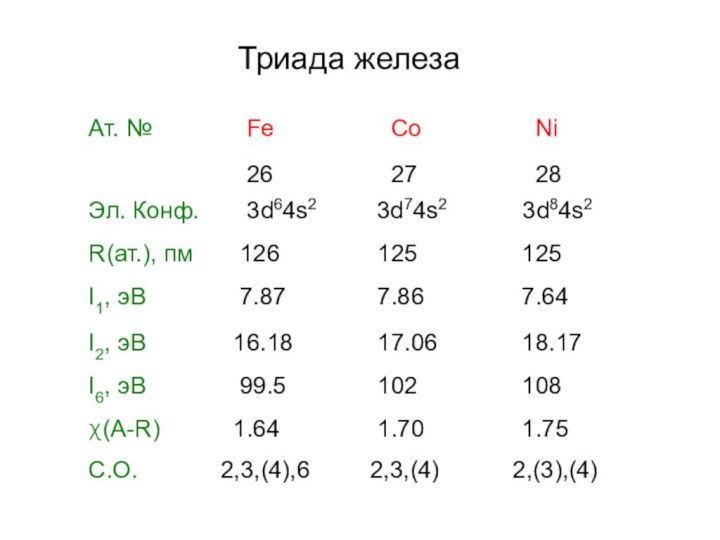
- 3. Триада железа
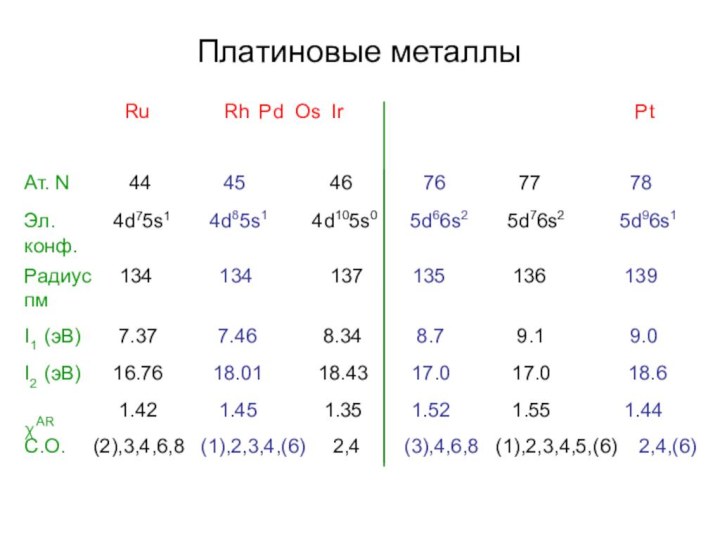
- 4. Платиновые металлыRuRh Pd Os IrPt
- 5. 3456 7 9 10 11 12Подгруппа железаFe – железо, Ru – рутений, Os – осмий
- 6. Химические свойства FeПассивируется концентрированными H2SO4, HNO3 и
- 7. Ржавеет4Fe + 3O2 + 2H2O = 4FeO(OH)Реагирует
- 8. 8. Реагирует с углеродомFe + C = Fe3C (цементит)Химические свойства Fe
- 9. Химические свойства Ru, Os1. Окисление кислородомOs +
- 10. Получение FeЖелезо – самый распространенный d-металл (4.1%),4й
- 11. Применение Fe, Ru, OsFe – стали, чугун.
- 12. Только Fe образует производные в с.о. +6Получение2Fe(OH)3
- 13. 2Na2FeO4 = Na3FeO4 + NaFeO2 + O2(700
- 14. Соединения Fe (III)Наиболее устойчивая с.о. FeИзвестны оксид
- 15. Соединения Fe (III)4. ГидроксидыFe2(SO4)3 + 6KOH =
- 16. Гидролиз соединений Fe(III)1. Акваион [Fe(H2O)6]3+ бесцветен2. Соли
- 17. Комплексы Fe(III)1. Аммиакаты неустойчивыFeBr3 + 6NH3 (газ)
- 18. Восстановление соединений Fe(III)1. Соединения Fe(III) – слабые
- 19. FeCl2, FeBr2, FeI2 растворимы, гидратированы в раствореFe
- 20. Соединения Fe (II)2. Оксид FeOСтруктура NaClНестехиометрия: Fe1–xO0.05
- 21. Соединения Fe (II)Оксид Fe3O4Fe3O4 ≡ Fe2O3·FeOобращенная шпинельFe3O4
- 22. Комплексы Fe(II)1. Устойчивы октаэдрические аквакомплексыFeCl2 (б/в) +
- 23. Комплексы Fe (II)4. Комплексы с лигандами сильного
- 24. Соединения Fe(0)1. КарбонилыFe + 5CO = Fe(CO)5(200
- 25. Высшие с.о. Ru, Os1. ПолучениеOs + 2O2
- 26. 1. Галогениды: известны RuF4, RuCl4, OsF4, OsCl4,
- 27. Низшие с.о. Ru, OsГалогениды: известны MX3 (кроме
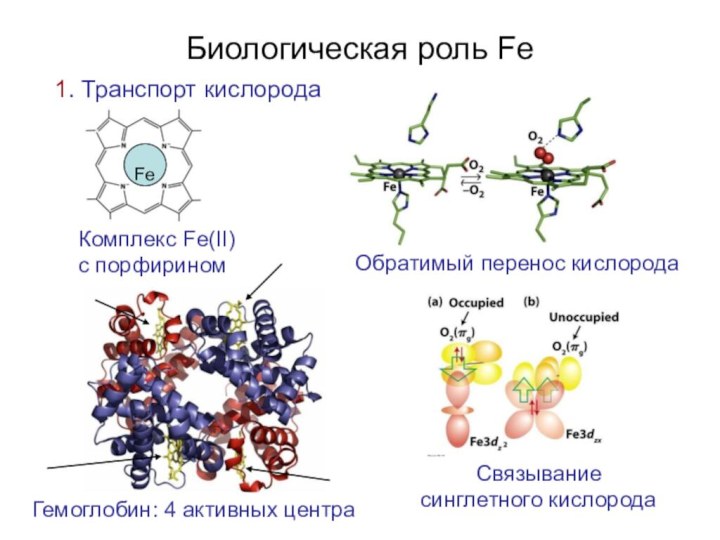
- 28. Биологическая роль Fe1. Транспорт кислородаFeКомплекс Fe(II)с порфириномОбратимый перенос кислородаСвязывание синглетного кислородаГемоглобин: 4 активных центра
- 29. Скачать презентацию
- 30. Похожие презентации









![Исходная презентация Подгруппа железа для подготовки урока химии на повышенном уровне Гидролиз соединений Fe(III)1. Акваион [Fe(H2O)6]3+ бесцветен2. Соли Fe(III) интенсивно окрашены (красные, коричневые)[Fe(H2O)6]3+](/img/tmb/6/512811/c375ecfdcb9bc42de926200ce5a86ff8-720x.jpg)
![Исходная презентация Подгруппа железа для подготовки урока химии на повышенном уровне Комплексы Fe(III)1. Аммиакаты неустойчивыFeBr3 + 6NH3 (газ) = [Fe(NH3)6]Br3 [Fe(H2O)6]Br32. Устойчивы комплексы с](/img/tmb/6/512811/26fb4ad55f6a289bda4baf3b5b9448d3-720x.jpg)


![Исходная презентация Подгруппа железа для подготовки урока химии на повышенном уровне Комплексы Fe(II)1. Устойчивы октаэдрические аквакомплексыFeCl2 (б/в) + 6NH3 = [Fe(NH3)6]Cl2[Fe(NH3)6]Cl2 + 2H2O](/img/tmb/6/512811/01d0a246cbe7f5f17940933874043a72-720x.jpg)
![Исходная презентация Подгруппа железа для подготовки урока химии на повышенном уровне Комплексы Fe (II)4. Комплексы с лигандами сильного поляK4[Fe(CN)6] + O2 ≠2K4[Fe(CN)6] +](/img/tmb/6/512811/d0e002b97529832606b7649265a5c1b6-720x.jpg)

![Исходная презентация Подгруппа железа для подготовки урока химии на повышенном уровне 2. Электрохимический транспорт: перенос энергииФерменты:пероксидаза, карбоксилаза, оксигеназа, нитрогеназа, гидрогеназа[Fe4S4]ферредиксинаБиологическая роль Fe«Кубановый кластер»](/img/tmb/6/512811/c2ae5eb3ebedb7a885066aaa0b3bd0fc-720x.jpg)
Слайд 6
Химические свойства Fe
Пассивируется концентрированными H2SO4, HNO3 и царской
водкой
Растворяется в кислотах-неокислителях
Fe + 2HCl = FeCl2 + H2
Fe2+
10Fe
+ 36HNO3 (разб) = 10Fe(NO3)3 + 3N2 + 18H2OНе растворяется в щелочах
Реагирует с кислородом при нагревании
мелкодисперсное чистое железо пирофорно!
Fe3+
4Fe + 3O2 = 2Fe2O3
Fe3+
Слайд 7
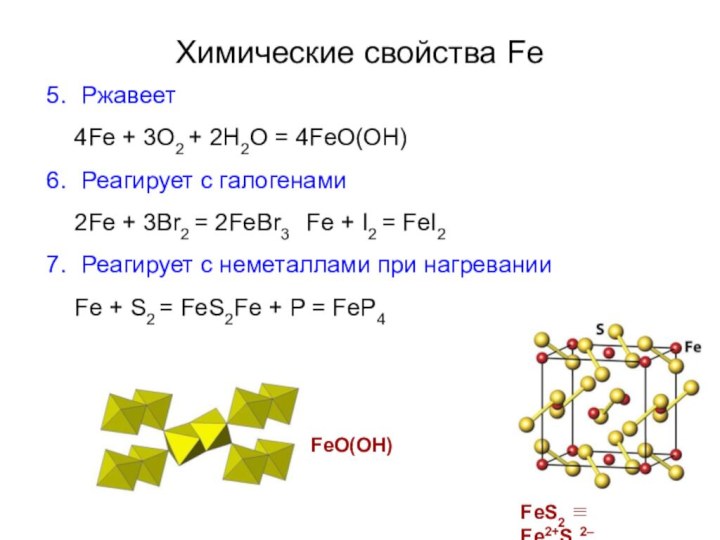
Ржавеет
4Fe + 3O2 + 2H2O = 4FeO(OH)
Реагирует с
галогенами
2Fe + 3Br2 = 2FeBr3 Fe + I2 = FeI2
Реагирует
с неметаллами при нагреванииFe + S2 = FeS2 Fe + P = FeP4
FeO(OH)
FeS2 ≡ Fe2+S22–
Химические свойства Fe
Слайд 9
Химические свойства Ru, Os
1. Окисление кислородом
Os + 2O2
= OsO4 (200 оС)
2. Окисление фтором
Ru + 3F2 = RuF6
Ru
+ O2 = RuO2(400 oC)
Os + 3F2 = OsF6
При Т > 1000 oC реагируют с S, Se, Te, P, Si, C, B,
но не N2
Ru + Si = RuSi
Не растворяются в кислотах-окислителях и щелочах
Щелочное окисление
Ru + 3NaNO3 + 2NaOH (ж) = Na2RuVIO4 + 3NaNO2 + H2O
аналогично для Os
Слайд 10
Получение Fe
Железо – самый распространенный d-металл (4.1%),
4й по
распространенности элемент в земной коре
основные минералы: Fe2O3 красный железняк,
гематит FeCO3 железный шпат, сидерит; Fe3O4 магнитный железняк, магнетит; FeTiO3 ильменит; FeOOH гётит; FeS2 железный колчедан, пиритДоменный процесс: Fe2O3 + CO = Fe + CO2
(700-900 oC)
«Прямое» получение: Fe3O4 + CH4 = 3Fe + CO2 + 2H2O
(1000 oC)
Сверхчистое железо: Fe(CO)5 = Fe + 5CO
(200 oC)
Слайд 11
Применение Fe, Ru, Os
Fe – стали, чугун. Чистое
железо не применяется!
α-Fe2O3 в ферритах
Оксиды Fe – пигменты
Fe2O3 в
составе катализаторовRu – в составе покрытий
6.
Ru, Os
изготовление сверхтвердых, инертных и износостойких инструментов
RuCl3·3H2O
Слайд 12
Только Fe образует производные в с.о. +6
Получение
2Fe(OH)3 +
10KOH + 3Br2 = 2K2FeO4 + 6KBr + 8H2O
K2FeO4
+ BaCl2 = BaFeO4↓ + 2KClкрасный
Устойчивость: стабильны только в щелочном растворе
4Na2FeO4 + 6H2O = 4FeO(OH) + 8NaOH + 3O2
Окислитель
2K2FeO4 + 16HCl = 2FeCl3 + 3Cl2 + 4KCl + 8H2O
4K2FeO4 + 10H2SO4 = 2Fe2(SO4)3 + 3O2 + 4K2SO4 + 10H2O
Соединения Fe(VI)
FeO42–
2K2FeO4 + 2NH3 = 2FeO(OH) + N2 + 4KOH
Слайд 13
2Na2FeO4 = Na3FeO4 + NaFeO2 + O2
(700 oC)
Соединения
Fe (IV, V)
Получение оксопроизводных
8Na2O2 + 2Fe2O3 = 4Na4FeO4 +
3O212KO2 + Fe3O4 = 3K4FeO4 + 8O2
2SrO + Fe2O3 + ½O2 = 2SrFeO3
Получение фторопроизводных
FeF2 + 2CsF + XeF2 = Cs2[FeF6] + Xe
Неустойчивы в растворе
(800 oC)
(900 oC)
(900 oC)
d4: t2g eg
3 1
3Na4FeO4 + 5H2O = Na2FeO4 + Fe2O3 + 10NaOH
4. Производные Fe(V) неустойчивы
Слайд 14
Соединения Fe (III)
Наиболее устойчивая с.о. Fe
Известны оксид и
гидроксиды
Fe2O3 – красное кристаллическое вещество, 5 кристаллических модификаций, основные:
α-Fe2O3 (гематит) γ-Fe2O3 (маггемит)α-Fe2O3 – низкая реакционная способность
γ-Fe2O3 – высокая реакционная способность
γ-Fe2O3
FeOOH
α-Fe2O3 γ-Fe2O3
400 оС
90 оС
γ-Fe2O3 + 6HCl = 2FeCl3 + 3H2O
γ-Fe2O3 + 6KOH (конц) + 6H2O = 2K3[Fe(OH)6]
α-Fe O
α-Fe2O3 + KOH ≠
α-Fe2O3 + HCl ≠
2 3
γ-Fe2O3
Слайд 15
Соединения Fe (III)
4. Гидроксиды
Fe2(SO4)3 + 6KOH = 2Fe(OH)3
+ 3K2SO4 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Fe(OH)3 + Ba(OH)2 (конц) = Ba[Fe(OH)5]5. Галогениды
Известны FeF3, FeCl3, FeBr3
2Fe + 3Cl2 = 2FeCl3
Fe2O3 + 3C + 3Cl2 = 2FeCl3 + 3CO FeCl3 + 6H2O = [FeCl2(H2O)4]Cl·2H2O
коричневый
белый
FeCl3
Слайд 16
Гидролиз соединений Fe(III)
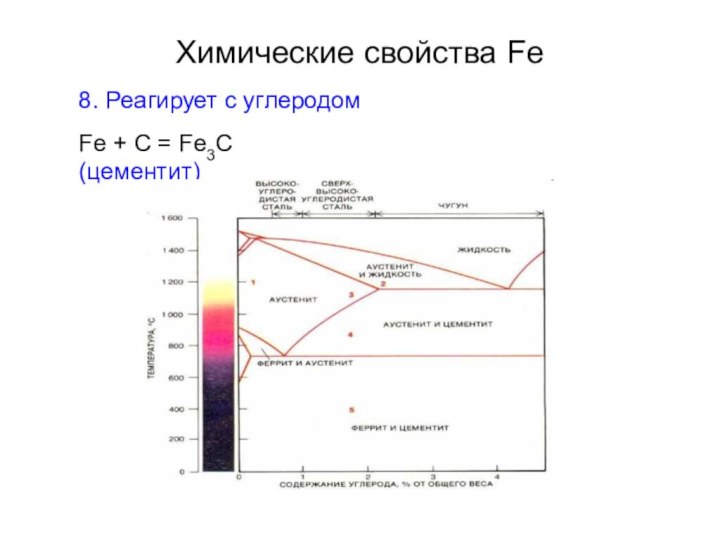
1. Акваион [Fe(H2O)6]3+ бесцветен
2. Соли Fe(III)
интенсивно окрашены (красные, коричневые)
[Fe(H2O)6]3+ + H2O ⇔ [Fe(OH)(H2O)5]2+ 2[Fe(OH)(H2O)5]2+
⇔ [(H2O)5FeOFe(H2O)5]4+ + H2O [Fe(H2O)6]Cl3 ⇔ [FeCl2(H2O)4]Cl·2H2OpK = 2.7
pK = 3.0
3. Гидролиз под действием производных слабых кислот Fe2(SO4)3 + 3Na2S + 4H2O = 2FeOOH + 3Na2SO4 + 3H2S Fe2(SO4)3 + 3Na2CO3 + H2O = 2FeOOH + 3Na2SO4 + 3CO2
E
t2g
eg
d5
высокоспиновый комплекс
ЭСКП = 0
Слайд 17
Комплексы Fe(III)
1. Аммиакаты неустойчивы
FeBr3 + 6NH3 (газ) =
[Fe(NH3)6]Br3 [Fe(H2O)6]Br3
2. Устойчивы комплексы с π-лигандами и хелатные
[Fe(H2O)6]3+ + SCN–
= [FeSCN(H2O)5]2+красный
Fe2(SO4)3 + 3K2C2O4 + 3BaC2O4 = 2K3[Fe(C2O4)3] + 3BaSO4
желтый
Fe2(SO4)3 + 3Ba(CN)2 + 6KCN = 2K3[Fe(CN)6] + 3BaSO4
красный
[FeSCN(H2O)5]2+
H2O
[Fe(ox)3]3–
[Fe(CN)6]
3–
Слайд 18
Восстановление соединений Fe(III)
1. Соединения Fe(III) – слабые окислители
в кислой среде
Fe2(SO4)3 + H2S = 2FeSO4 + H2SO4
+ S Fe2(SO4)3 + SO2 + 2H2O = 2FeSO4 + 2H2SO42Fe2(SO4)3 + 2(NH3OH)HSO4 = 4FeSO4 + N2O + 4H2SO4 +H2O
Fe2(SO4)3 + 2KI = 2FeSO4 + K2SO4 + I2
2. Влияние комплексообразования: E0(Fe3+/Fe2+) = 0.77 В E0([Fe(CN)6]3–/[Fe(CN)6]4–) = 0.36 В
E0([Fe(С2О4)3]3–/[Fe(С2О4)3]4–) = 0.02 В -2.5
K3[Fe(С2О4)3] + KI ≠
0
1
2
3
0.0
-0.5
-1.0
-1.5
-2.0
nE
4K3[Fe(CN)6] + 4KOH (конц) = 4K4[Fe(CN)6] + 2H2O + O2
n
[Fe(H2O)6]n+
[Fe(CN)6]n–
Слайд 19
FeCl2, FeBr2, FeI2 растворимы, гидратированы в растворе
Fe +
2HBr = FeBr2 + H2 Fe + I2 =
FeI2FeF2 нерастворим в воде
Слайд 20
Соединения Fe (II)
2. Оксид FeO
Структура NaCl
Нестехиометрия: Fe1–xO
0.05
x < 0.16
Только основные свойства окисляется при нагревании
6FeO +
O2 = 2Fe3O4Получение:
FeO + 2HCl = FeCl2 + H2O
(600 oC)
FeC2O4 FeO + CO + CO2
FeO
200 C
o
Слайд 21
Соединения Fe (II)
Оксид Fe3O4
Fe3O4 ≡ Fe2O3·FeO
обращенная шпинель
Fe3O4 –
ферромагнетик, TC = 630 oC Fe3O4 + 8HCl =
FeCl2 + 2FeCl3 + 4H2OFe3O4
Гидроксид
преимущественно основные свойства Fe(OH)2
pKb = 3.9
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
6Fe(OH)2 + O2 = 2Fe3O4 + 6H2O окисление
Слайд 22
Комплексы Fe(II)
1. Устойчивы октаэдрические аквакомплексы
FeCl2 (б/в) + 6NH3
= [Fe(NH3)6]Cl2
[Fe(NH3)6]Cl2 + 2H2O = Fe(OH)2 + 2NH4Cl +
4NH3FeSO4 + (NH4)2SO4 = (NH4)2Fe(SO4)2·6H2O
Тетраэдрические комплексы неустойчивы
2CsCl + FeCl2 = Cs2[FeCl4]
Ферроцен
FeCl2 + 2Na(cp) = Fe(cp)2 + 2NaCl
(соль Мора)
(NH4)2Fe(SO4)2·6H2O
Fe(cp)2
Слайд 23
Комплексы Fe (II)
4. Комплексы с лигандами сильного поля
K4[Fe(CN)6]
+ O2 ≠
2K4[Fe(CN)6] + Cl2 = 2K3[Fe(CN)6] + 2KCl
E
e gt
2g
ЭСКП = 12/5 ΔО
μ = 0
Fe2+ d6
Слайд 24
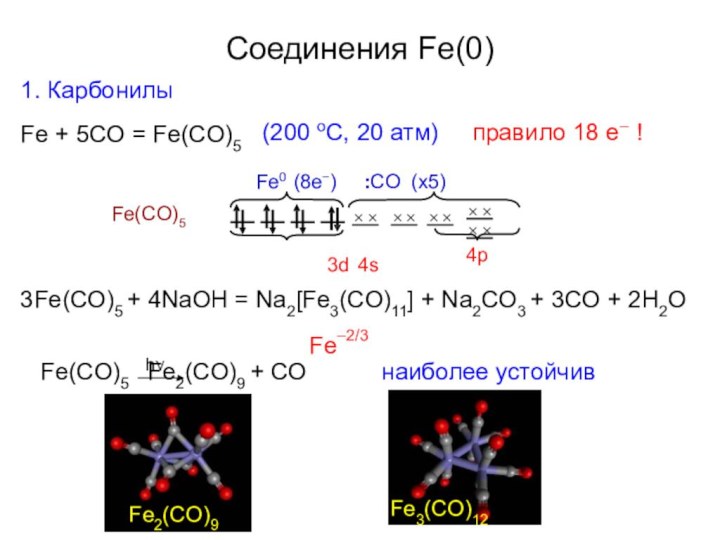
Соединения Fe(0)
1. Карбонилы
Fe + 5CO = Fe(CO)5
(200 oC,
20 атм)
Fe0 (8e−) :CO (x5)
×× ×× ××
3d 4s
правило 18 е– !
3Fe(CO)5 + 4NaOH
= Na2[Fe3(CO)11] + Na2CO3 + 3CO + 2H2OFe–2/3
Fe(CO)5 Fe2(CO)9 + CO
наиболее устойчив
hν
Fe(CO)5
×× ××
4p
Fe3(CO)12
Fe2(CO)9
Слайд 25
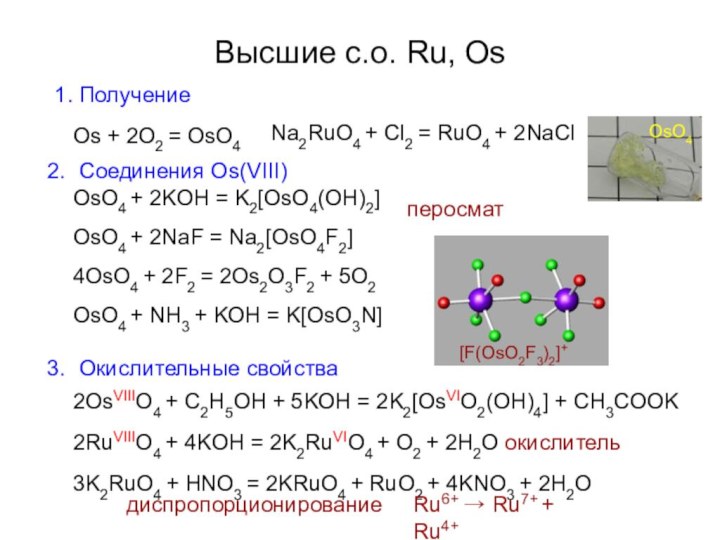
Высшие с.о. Ru, Os
1. Получение
Os + 2O2 =
OsO4
Na2RuO4 + Cl2 = RuO4 + 2NaCl
Соединения Os(VIII)
OsO4 +
2KOH = K2[OsO4(OH)2] OsO4 + 2NaF = Na2[OsO4F2] 4OsO4 + 2F2 = 2Os2O3F2 + 5O2 OsO4 + NH3 + KOH = K[OsO3N]Окислительные свойства
перосмат
2OsVIIIO4 + C2H5OH + 5KOH = 2K2[OsVIO2(OH)4] + CH3COOK
2RuVIIIO4 + 4KOH = 2K2RuVIO4 + O2 + 2H2O окислитель
3K2RuO4 + HNO3 = 2KRuO4 + RuO2 + 4KNO3 + 2H2O
[F(OsO2F3)2]+
OsO4
Ru6+ → Ru7+ + Ru4+
диспропорционирование
Слайд 26
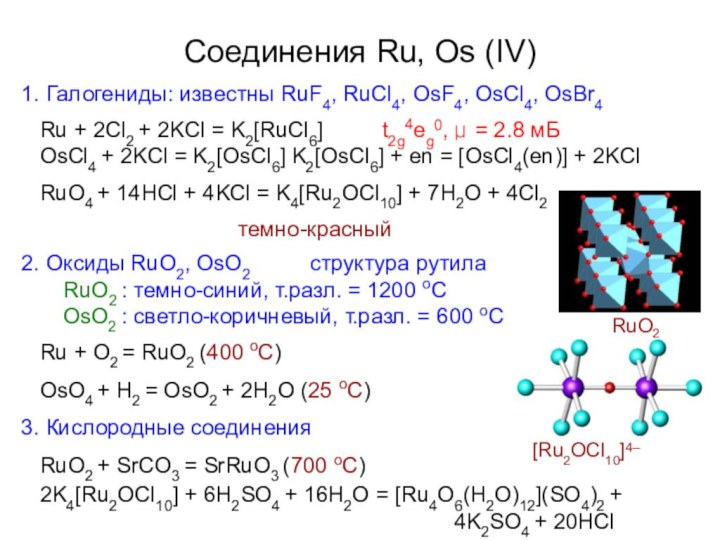
1. Галогениды: известны RuF4, RuCl4, OsF4, OsCl4, OsBr4
Ru
+ 2Cl2 + 2KCl = K2[RuCl6]
t2g4eg , μ =
2.8 мБ0
OsCl4 + 2KCl = K2[OsCl6] K2[OsCl6] + en = [OsCl4(en)] + 2KCl RuO4 + 14HCl + 4KCl = K4[Ru2OCl10] + 7H2O + 4Cl2
темно-красный
2. Оксиды RuO2, OsO2
структура рутила
RuO2 : темно-синий, т.разл. = 1200 оС
OsO2 : светло-коричневый, т.разл. = 600 оС
Ru + O2 = RuO2 (400 oC)
OsO4 + H2 = OsO2 + 2H2O (25 oC)
3. Кислородные соединения
RuO2 + SrCO3 = SrRuO3 (700 oC)
2K4[Ru2OCl10] + 6H2SO4 + 16H2O = [Ru4O6(H2O)12](SO4)2 +
[Ru2OCl10]
4–
Соединения Ru, Os (IV)
RuO
4K2SO4 + 20HCl
2
Слайд 27
Низшие с.о. Ru, Os
Галогениды: известны MX3 (кроме OsF3),
MX2 (кроме MF2)
2Ru + Cl2 = 2RuCl3 2RuO4 + 16HI
(aq) = 2RuI3 + 5I2 + 8H2O2RuO4 + 16HCl (конц) + 6KCl = 2K3[RuCl6] + 5Cl2 + 8H2O
Комплексы Ru, Os (III) все – октаэдры, низкоспиновые
RuCl3·3H2O + 2NaCl = Na2[RuCl5(H2O)] + 2H2O
красный
RuCl3·3H2O + 3H2C2O4 = H3[Ru(C2O4)3]+3HCl+3H2O
темно-зеленый
2K2[OsO2(OH)4] + 16HCl (конц) + 2KCl = 2K3[OsCl6] + 12H2O + 3Cl2
[Ru(H2O)6]3+ + e– = [Ru(H2O)6]2+
[Ru(NH3)6]3+ + e– = [Ru(NH3)6]2+
3. Комплексы Ru(II)
E0 = +0.23 В
E0 = +0.24 В
[Ru(NH3)5(H2O)]Cl2 + N2
[Ru(NH3)5(N2)]Cl2 + H2O
P





























