положению в ПС;
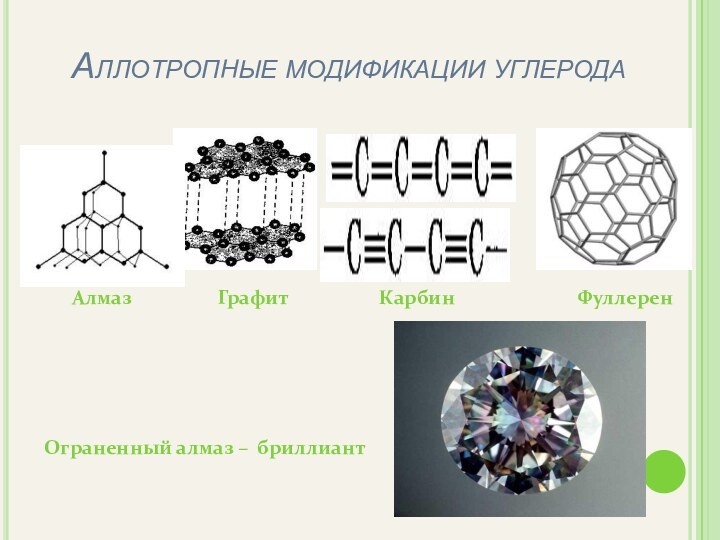
– изучить аллотропные модификации углерода;
– изучить химические
свойства и применение углерода;– изучить строение, свойства, получение и применение оксидов углерода II, IV;
– изучить строение, свойства и применение угольной кислоты.