гибридизации атомных орбиталей в органических соединениях;
научить применять данные
знания для объяснения гибридизации в неорганических соединениях;Закрепить знания зависимости пространственного строения молекул частицы от типа гибридизации.




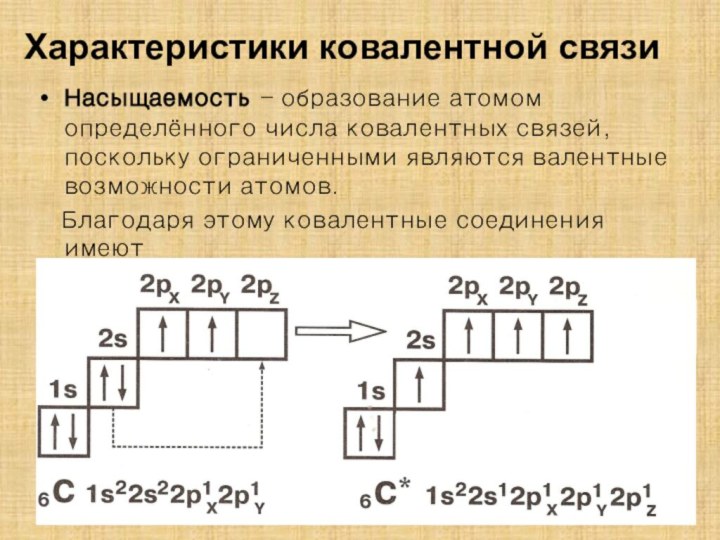
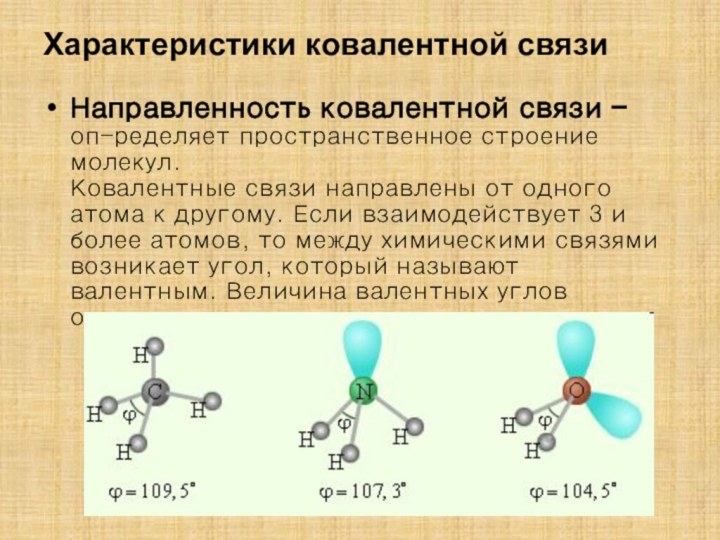
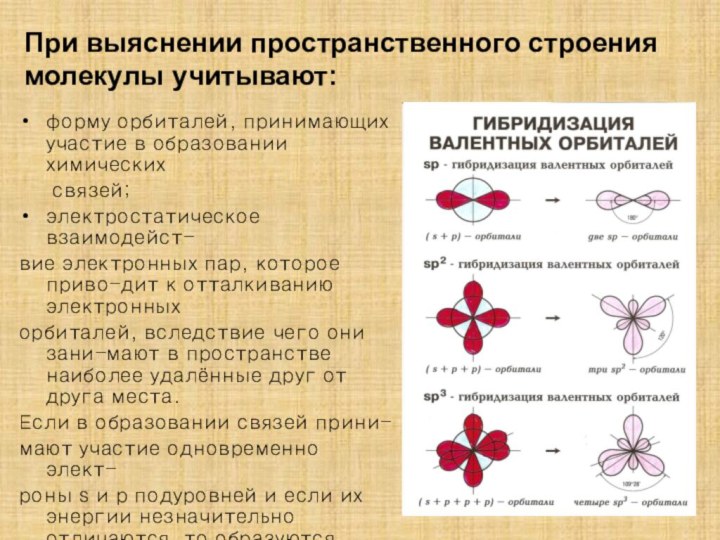

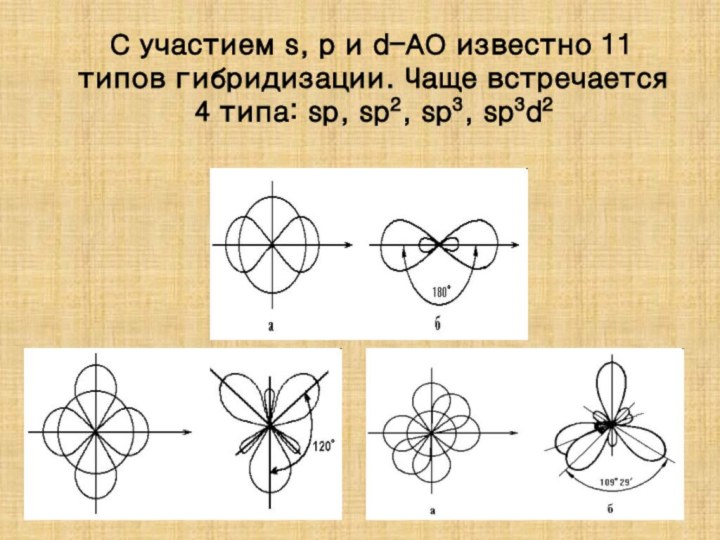

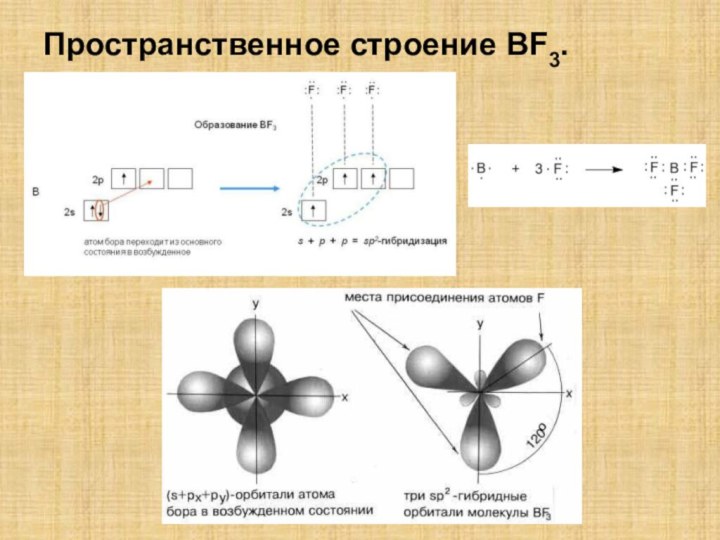
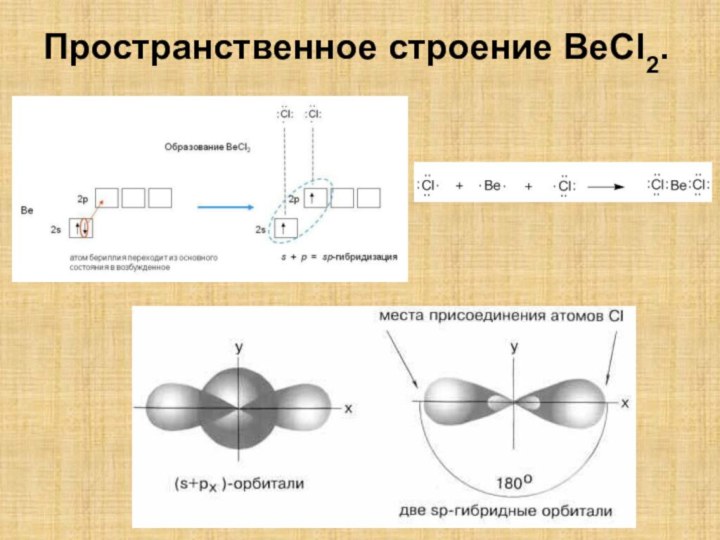
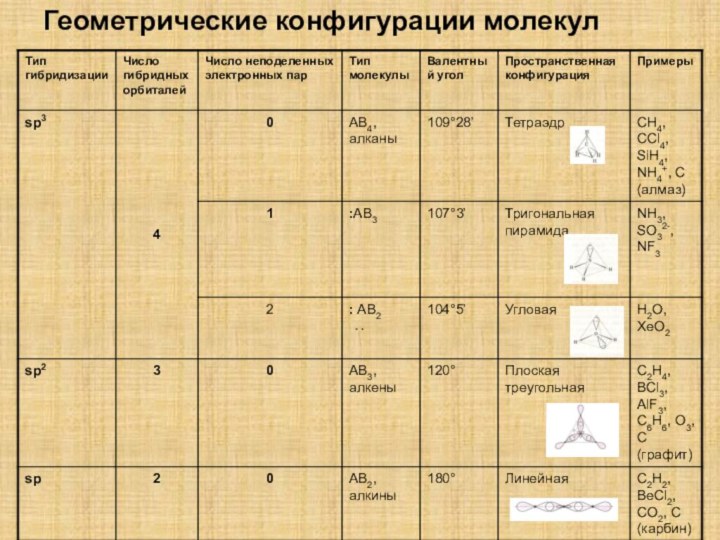
























![Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер](/img/tmb/15/1406372/1c2270808e41b51e646d25cbcc82036f-210x.jpg)






