- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Алканы. Алкены. Алкины
Содержание
- 2. И так начнем с Алканов
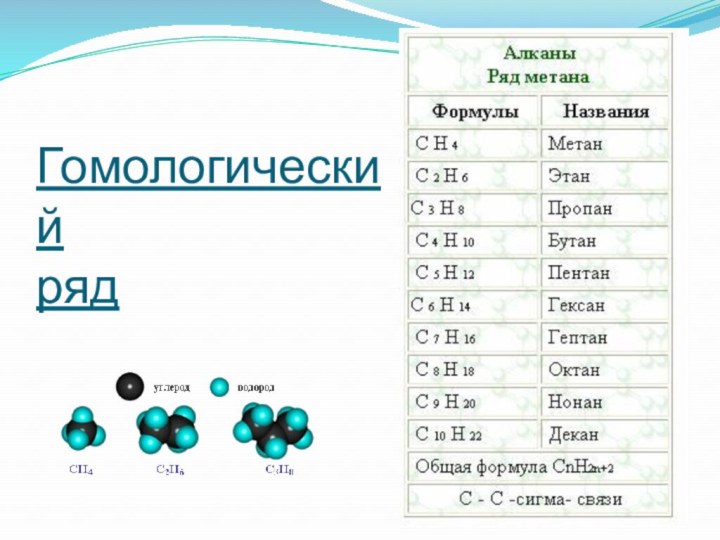
- 3. Алканы – углеводороды, в молекулах которых атомы связаны ординарными связями и которые соответствует общей формуле CnH2n+2
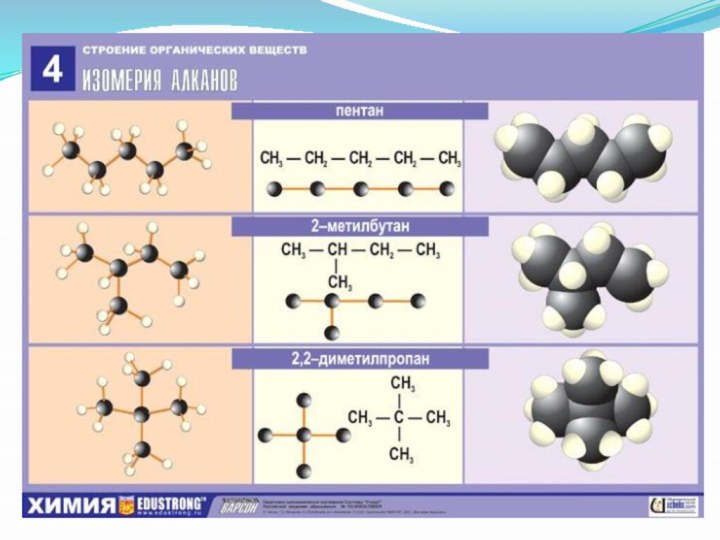
- 4. Алканы являются насыщенными углеводородами и содержат максимально
- 5. Строение молекулы метана
- 6. Строение молекулы этана и бутана
- 7. Гомологический
- 9. Физические свойства Алканы в любом агрегатном
- 10. Биологическое действие При хроническом действии нарушают работу
- 11. Химические свойстваРеакция замещенияГалогенированиеРеакция КоноваловаРеакция разложенияДегидрированиеКрекингРеакции, сопровождающиеся разрушением углеводородной цепиГорениеТермическое расщеплениеИзомеризацияАроматизация
- 12. Применение метана
- 13. Теперь перейдем к алкенам
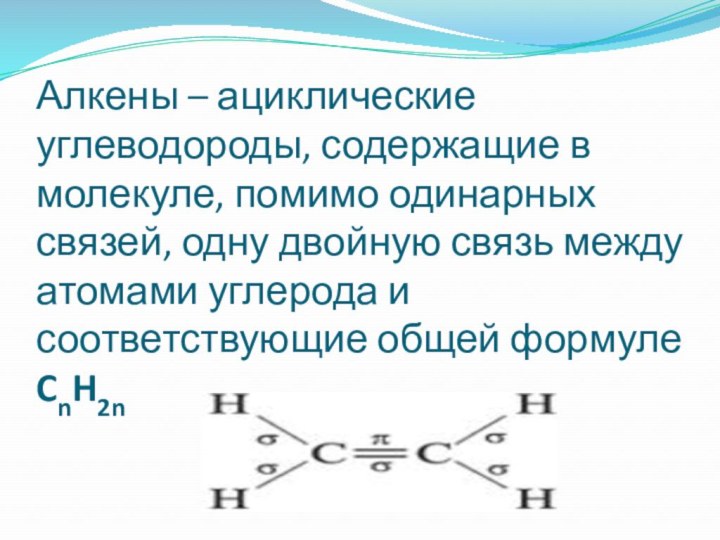
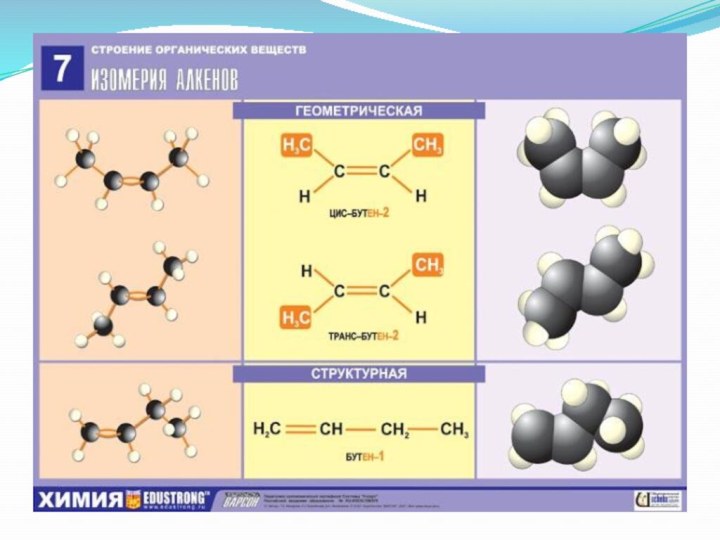
- 14. Алкены – ациклические углеводороды, содержащие в молекуле,
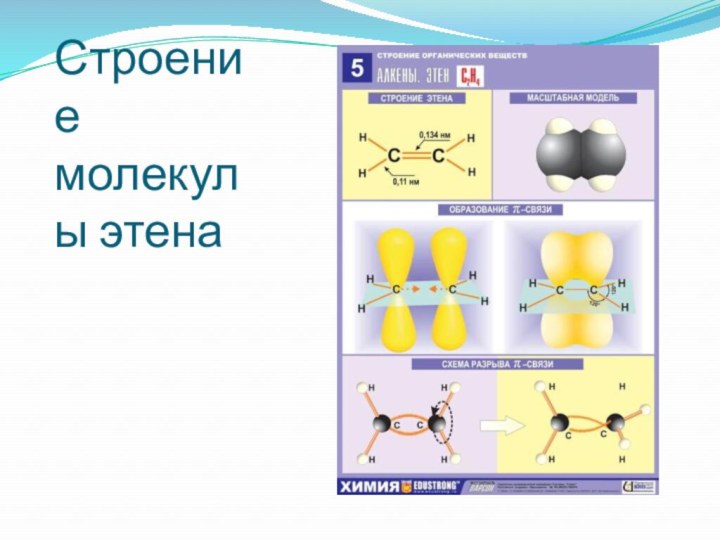
- 15. Строение молекулы этена
- 16. ОЛЕФИНЫ (алкены), ненасыщенные ациклические углеводороды, содержащие в
- 18. Гомологический ряд
- 20. Физические свойства Первые три представителя гомологического
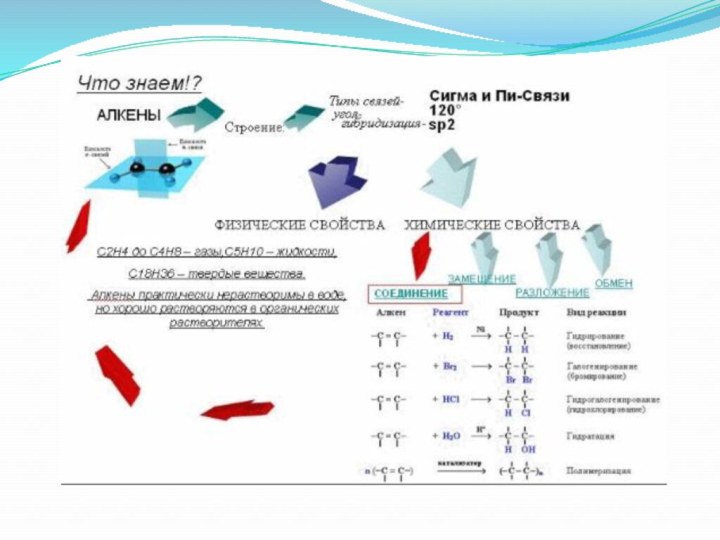
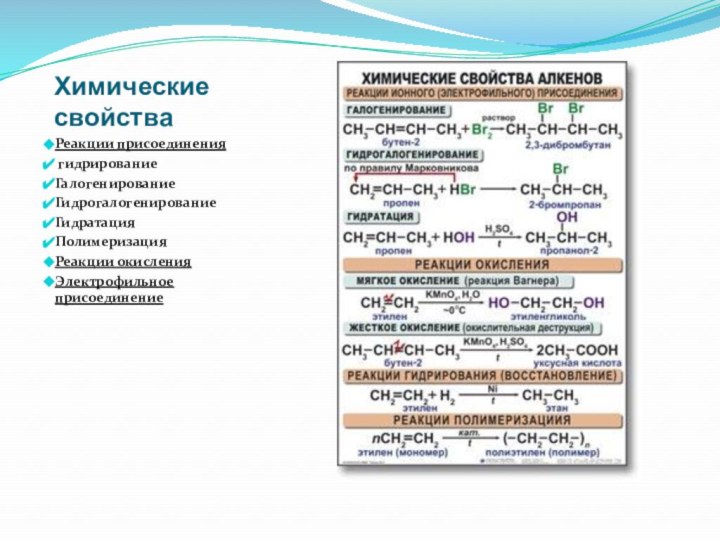
- 21. Химические свойстваРеакции присоединения гидрированиеГалогенированиеГидрогалогенированиеГидратацияПолимеризацияРеакции окисленияЭлектрофильное присоединение
- 23. И немого об Алкинах
- 24. Алкины – ациклические углеводороды, содержащие в молекуле,
- 25. Атомы углерода, между которыми образованна тройная связь,
- 26. Строение молекулы этина
- 27. Гомологический ряд
- 28. Физические свойства Температура кипения и плавления
- 29. Химические свойстваРеакции присоединения гидрированиеГалогенированиеГидрогалогенированиеГидратацияТримеризация ДимеризацияРеакции окисления
- 30. Применение алкинов
- 31. Вот и все что я хотела вам показать!)))
- 32. Скачать презентацию
- 33. Похожие презентации
И так начнем с Алканов