характеристика d - элементов
2. Кислотно-основные свойства оксидов и гидроксидов
3.
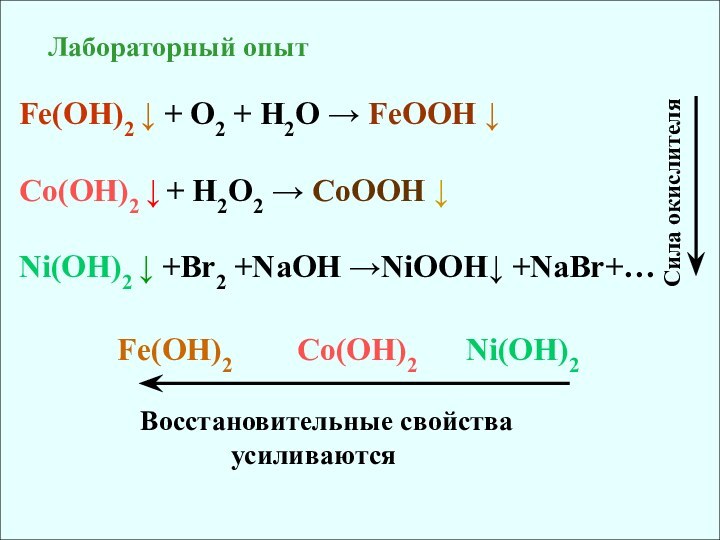
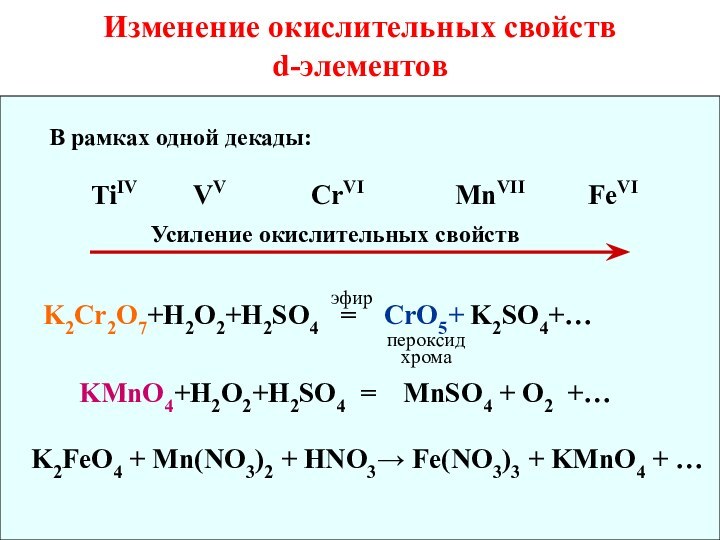
Восстановительные и окислительные свойства d-элементов4. d-элементы - хорошие комплексообразователи
5. Физические свойства. Руды. Способы получения.
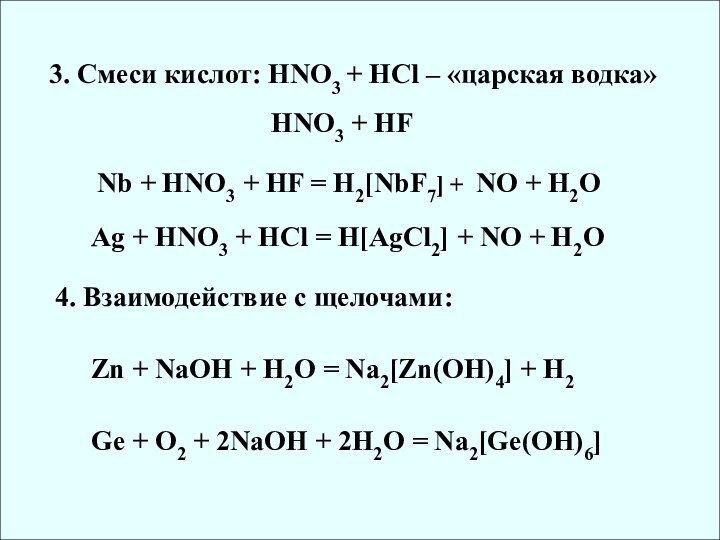
6. Ряд напряжения металлов. Химические свойства металлов.





![d — элементы Cr [Ar] 3d54s1Mn [Ar] 3d54s2Fe [Ar] 3d64s2Co [Ar] 3d74s2Ni [Ar] 3d84s2Cu [Ar]](/img/tmb/12/1124801/618527082c927da8cceac510481f2327-720x.jpg)




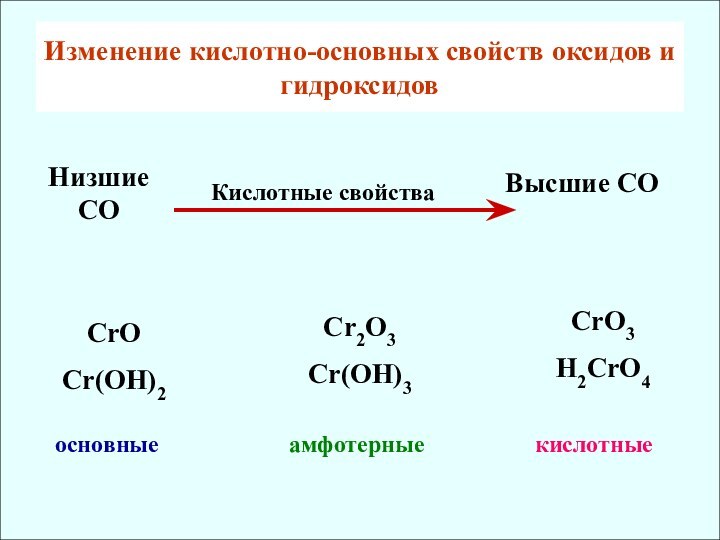

![d — элементы Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит натрияCr2O3](/img/tmb/12/1124801/bf4c0c63d7dbe22c1921c32f2993ba9f-720x.jpg)




![d — элементы CoCl2 + 4KSCN K2[Co(SCN)4] + 2KClЭту способность используют:1) для очистки d-элементов](/img/tmb/12/1124801/391c572a24a4c746dc3cdbc32c972f46-720x.jpg)
![d — элементы 2) Для разделения близких по свойствам элементов:ZnSO4CdSO4+ NaOHизбыток Na2[Zn(OH)4]растворCd(OH)2 + Na2SO4AgCl ](/img/tmb/12/1124801/d02391a551138af1e8eb31b2ea3a53df-720x.jpg)
![d — элементы Fe2+ + K3[Fe(CN)6] = KFeFe(CN)6 + …IIIII IIIFe3+ +](/img/tmb/12/1124801/31ba4ac4ef8a4b649199b9dbf8a9724f-720x.jpg)








![d — элементы Au + KCN + O2 + H2O = K[Au(CN)2] + KOHK[Au(CN)2] +](/img/tmb/12/1124801/8a96292820d9201cc22fdc23ca03db7a-720x.jpg)



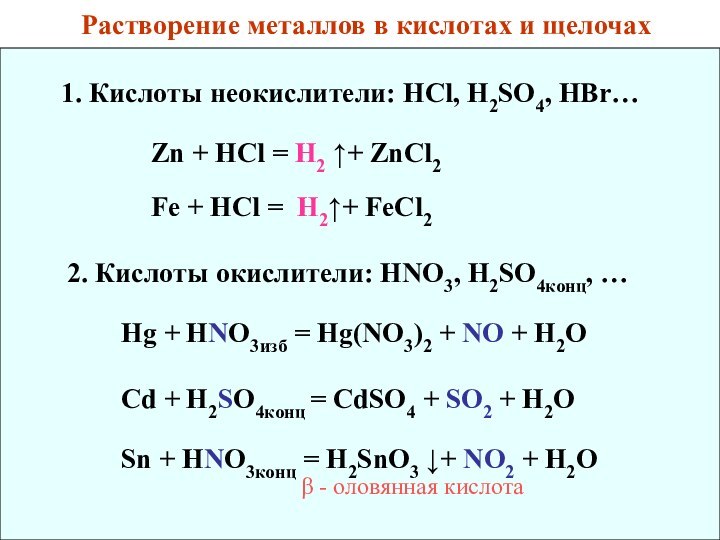
2 + H2↑Cd](/img/tmb/12/1124801/3508545915149748e8594661d73c9101-720x.jpg)





























