Слайд 2
Что такое ферменты?
ФЕРМЕНТЫ (от лат. fermentum
— брожение, закваска) – это энзимы, специфические белки, увеличивающие
скорость протекания химических реакций в клетках всех живых организмов.
Наука о ферментах называется энзимологией.
Они значительно эффективнее (в 1014 –1015 раз) небиологических катализаторов.
Ферменты не капризны,
однако каждая ферментативная
реакция наиболее быстро
протекает при строго
определенном значении PH и t° C
Слайд 3
Процессы, протекающие при участии ферментов, известны человеку с
глубокой древности, ведь в основе приготовления хлеба, сыра, вина
и уксуса лежат ферментативные процессы.
В конце 19 в. было доказано, что сок, получаемый при растирании дрожжевых клеток, содержит сложную смесь ферментов, обеспечивающих процесс спиртового брожения.
С этого времени началось интенсивное изучение ферментов — их строения и механизма действия.
Слайд 4
Термин «фермент» был предложен в XVII
веке химиком ван Гельмонтом при исследовании механизмов пищеварения.
Слайд 5
В 1833 французскими химиками А. Пайеном и Ж.
Персо впервые из прорастающих зерен ячменя было выделено активное
вещество, осуществляющее превращение крахмала в сахар и получившее название диастазы(амилазы).
Слайд 6
В середине 19 в. разгорелась дискуссия о
природе брожения. Пастер считал, что брожение вызывается лишь живыми
микроорганизмами и что процесс брожения неразрывно связан с их жизнедеятельностью. А Либих и его сторонники, отстаивая химическую природу брожения, считали, что оно является следствием образования в клетках микроорганизмов растворимых ферментов.
Луи Пастер
Юстас Либих
Марселен Бертло
Клод Бернар
Слайд 7
Дискуссия Либиха и Пастера о природе брожения была
разрешена в 1897 Э.Бухнером, который, растирая дрожжи с инфузорной
землёй, выделил из них бесклеточный растворимый ферментный препарат (зимазу), вызывавший спиртовое брожение. Открытие Бухнера утвердило материалистическое понимание природы брожений.
Слайд 9
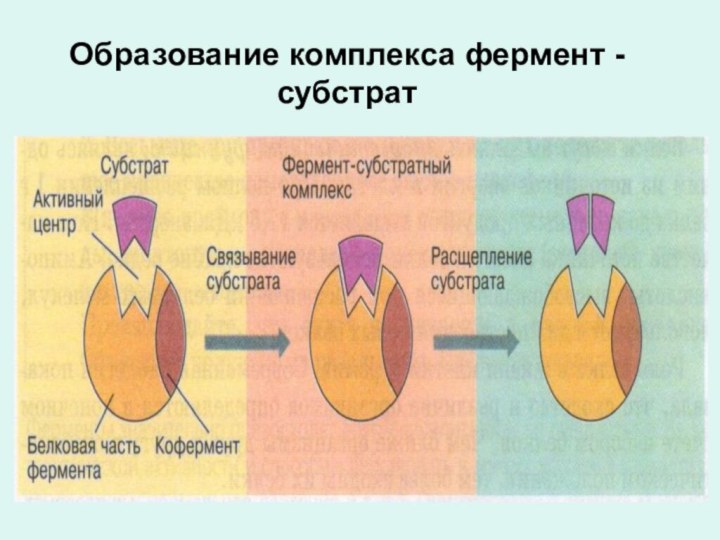
Принцип действия ферментов
Фермент и субстрат должны подходить
друг
к другу «как ключ к замку»
Слайд 10
Образование комплекса фермент - субстрат
Слайд 11
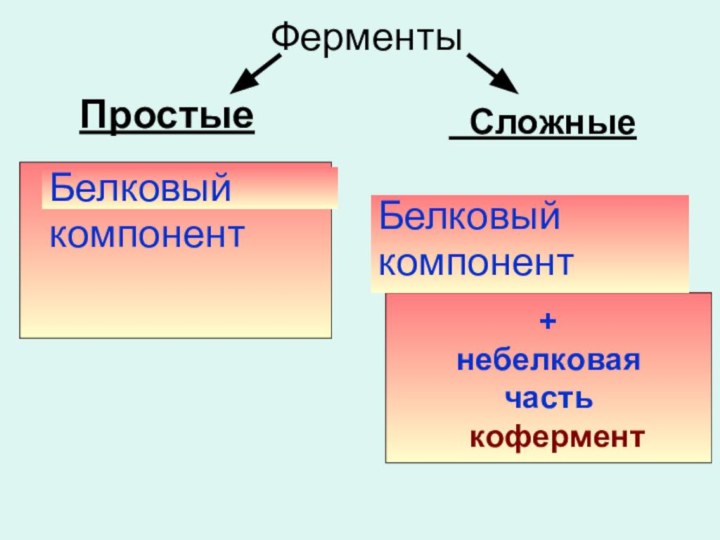
Размеры ферментов и их строение.
Молекулярная масса ферментов, лежит
в пределах
10 тыс. — 1 млн. Они могут
состоять из одной или нескольких полипептидных цепей и могут быть представлены сложными белками.
Слайд 12
Функции ферментов
Ферменты выступают в роли катализаторов практически во
всех биохимических реакциях, протекающих в живых организмах — ими
катализируется около 4000 биореакций.
Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма..
Слайд 13
Местонахождение ферментов в организме
В клетке часть ферментов
находится в цитоплазме, но в основном ферменты связаны с
определенными клеточными структурами.
В ядре, например, находятся ферменты, ответственные за репликацию — синтез ДНК и за ее транскрипцию — образование РНК .
ДНК-лигаза
Слайд 14
Условия действия ферментов
Действие ферментов зависит от ряда факторов:
От
температуры (max 40-50°С)
Активной реакции среды – pH (кислотность).
От присутствия
специфических активаторов и неспецифических или специфических ингибиторов.
Слайд 15
Специфичность и механизм действия ферментов
Действие ферментов, строго
специфично и зависит от строения субстрата, на который фермент
действует. Прекрасным примером такой зависимости служит катализируемая аргиназой реакция гидролитического расщепления аминокислоты аргинина на орнитин и мочевину:
Слайд 16
Кофакторы ферментов
Многие ферменты для проявления активности нуждаются в
веществах небелковой природы- кофакторах.
Кофакторы могут быть как неорганическими
молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем).
Слайд 17
Получение ферментов
Обычно ферменты выделяют из тканей животных, растений,
клеток и культуральных жидкостей микроорганизмов, биологических жидкостей (кровь, лимфа
и др.).
Для получения некоторых труднодоступных ферментов используются методы генетической инженерии.
Слайд 18
Классификация и номенклатура ферментов
Каждый фермент имеет 2 названия.
Первое - короткое, так называемое рабочее, удобное для повседневного
использования.
Второе (более полное) - систематическое, применяемое для однозначной идентификации фермента.
Рабочее название
В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза, пируваткарбоксилаза.
Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например трипсин, пепсин, реннин, тромбин.
Слайд 19
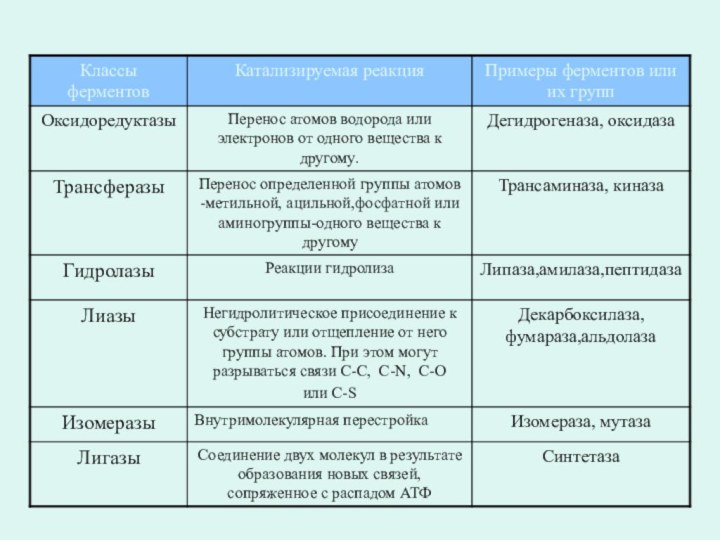
Классы ферментов
Международный союз биохимии и молекулярной
биологии в 1961 г. разработал систематическую номенклатуру, согласно которой
все ферменты разбиты на 6 основных классов в зависимости от типа катализируемой химической реакции.
Каждый класс состоит из многочисленных подклассов и подподклассов с учётом преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д.
Каждый из 6 классов имеет свой порядковый номер, строго закреплённый за ним.
Слайд 21
Гипоксантин-гуанинфосфорибозилтрансфераза
Слайд 22
Модель фермента
Нуклеозидфосфорилазы
Слайд 23
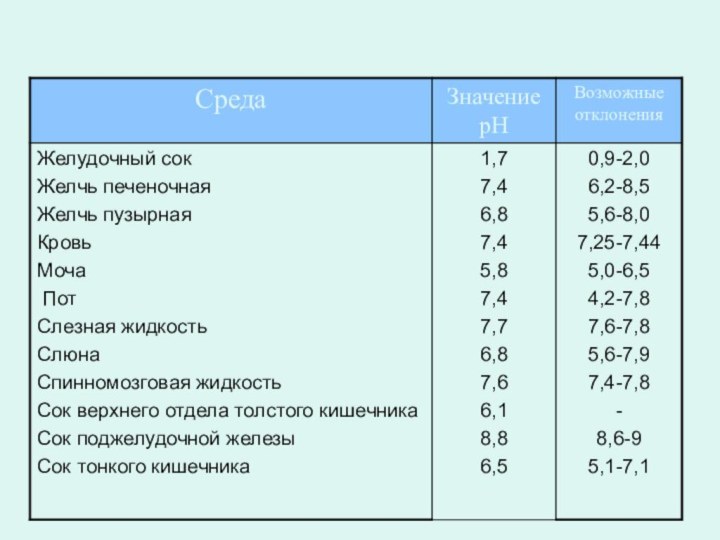
Значения pH физиологических жидкостей
Слайд 24
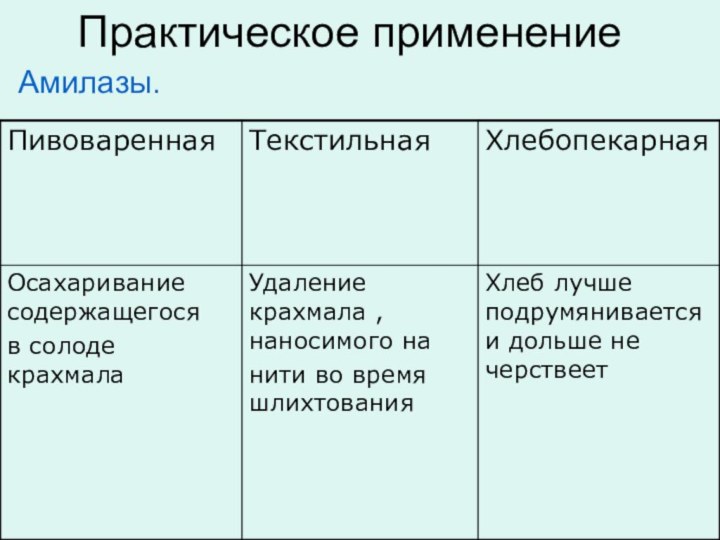
Практическое применение
Амилазы.
Слайд 25
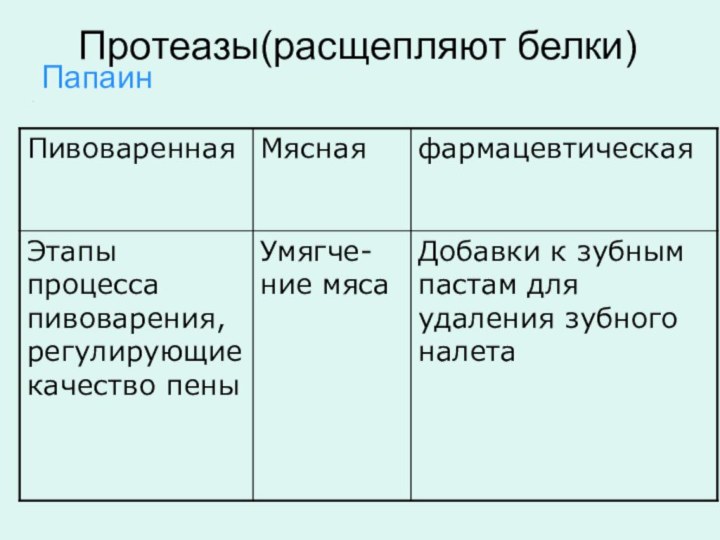
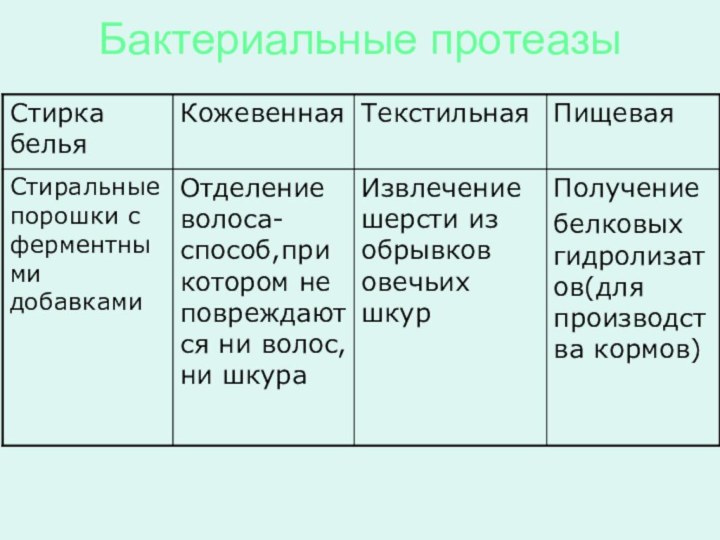
Протеазы(расщепляют белки)
Папаин
.
Слайд 26
Фицин
Смывание желатина
с использованной
пленки для того,
чтобы извлечь
находящееся в нем
серебро
Трипсин
Пищевая -
производство продуктов для детского питания
Реннин
Сыроварение - свертывание молока
(получение сгустка казеина)
Слайд 29
Где наш организм берёт ферменты?
Определённый ферментный потенциал мы
наследуем при рождении. Этот ограниченный запас рассчитан на всю
жизнь. Чем быстрее вы израсходуете энергию ферментов, тем быстрее вы «выдохнетесь». Вы живёте так долго, пока ваш организм обладает факторами ферментной активности, из которых он производит новые ферменты.
Когда вы достигаете такого момента, когда ваш организм больше не способен производить ферменты, ваша жизнь заканчивается.
Для людей основным источником «дополнительных» ферментов является пища. Она должна содержать их «определенный набор». Если ферменты присутствуют в еде, то они сами осуществляют значительную часть работ по перевариванию пищи. Но если вы едите пищу, прошедшую термическую обработку, лишённую ферментов, организм вынужден сам производить ферменты для переваривания. Это намного уменьшает ограниченный ферментный потенциал.
Слайд 30
Сегодня известно, что раковые клетки защищены белковой оболочкой,
которая мешает иммунной системе их распознать. Удалить эту оболочку
могут только ферменты, разоблачая, таким образом, злокачественные клетки. Вот почему онкологическим больным в их диете ограничивают мясо или исключают его вовсе: этим самым сберегают ферменты, уходящие на расщепление мяса, дают им возможность участвовать в разоблачении раковых клеток
Так что, если вы едите что-то вареное, а мясо всегда подвергаете тепловой или иной обработке, то обязательно ешьте вместе с вареным продуктом в 3 раза больше сырых овощей.
Слайд 31
Ферменты постоянно работают в организме: без
них не совершается ни один процесс.
Они расщепляют пищу
на клеточном уровне, создают из белков мышцы, выделяют из легких углекислый газ, поддерживают работу иммунной системы в ее борьбе с инфекцией, повышают уровень выносливости организма, помогают пищеварительной системе правильно функционировать. Кроме всего перечисленного, ферменты:
— уничтожают и выводят из организма различные жиры;
— предупреждают хроническое течение болезни;
— сохраняют нам молодость и помогают хорошо выглядеть;
— усиливают энергию и выносливость;
— препятствуют гормональному дисбалансу в организме.
Слайд 32
У растений при температуре ниже 0o С
действие ферментов полностью не прекращается, хотя жизнедеятельность растений при
этом резко снижается. Ферментативные процессы, как правило, не могут протекать при температуре выше 70o С, так как ферменты, как и всякие белки подвержены тепловой денатурации (разрушению структуры).
Слайд 33
Болезни, связанные с нарушением выработки ферментов.
Отсутствие или снижение
активности какого-либо фермента у человека приводит к развитию заболеваний
или гибели организма.
Например передаваемое по наследству заболевание детей — галактоземия (приводит к умственной отсталости) — развивается вследствие нарушения синтеза фермента, ответственного за превращение галактозы в легко усваиваемую глюкозу.
Слайд 34
Причиной другого наследственного заболевания — фенилкетонурии, сопровождающегося расстройством
психической деятельности, является потеря клетками печени способности синтезировать фермент,
катализирующий превращение аминокислоты фенилаланина в тирозин.
Определение активности многих ферментов в крови, моче, спинно-мозговой, семенной и других жидкостях организма используется для диагностики ряда заболеваний. С помощью такого анализа сыворотки крови возможно обнаружение на ранней стадии инфаркта миокарда, вирусного гепатита, панкреатита, нефрита и других заболеваний.
Слайд 35
Применение ферментов
Ферментативные процессы являются основой многих производств:
хлебопечения, виноделия, пивоварения, сыроделия, производства спирта, чая, уксуса.
Слайд 36
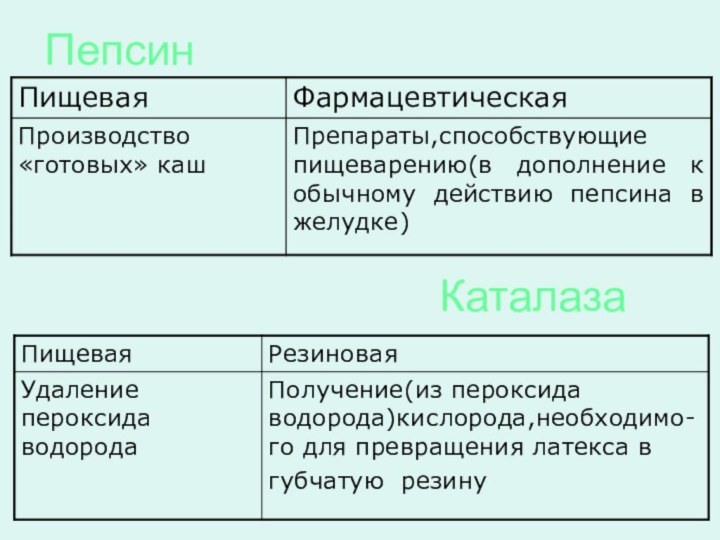
Каталаза широко применяется в пищевой и резиновой промышленности,
а расщепляющие полисахариды целлюлазы и пектидазы — для осветления
фруктовых соков
Слайд 37
С помощью ферментов получают лекарственные препараты и сложные
химические соединения.
Слайд 38
протеолитический фермент папайи (из сока папайи) — в пивоварении,
для смягчения мяса
Слайд 39
пепсин — при производстве «готовых» каш и как
лекарственный препарат
Слайд 40
трипсин — при производстве продуктов для детского питания;