- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Металлы. Общие свойства металлов
Содержание
- 2. Общие свойства металловобусловлены:- Строением атома- Наличием кристаллической решетки- Наличием металлической связи
- 3. Расположение металлов в периодической системе Д.И. Менделеева
- 4. s-металлы: элементы IA и IIA групп.Свойства s-металлов:–
- 5. p-металлы: элементы IIIA (кроме бора B), IVA
- 6. d-металлы: 30 элементов, расположенных в серединах периодов
- 7. f-металлы: лантаноиды и актиноиды. У этих элементов
- 8. Черные металлыЧерные металлы характеризуются темно-серым цветом, большой
- 9. Черные подразделяются:Железные металлы - Fe, Co, Ni
- 10. Цветные металлыЦветные металлы характеризуются: характерной окраской (красная, желтая, белая), большой пластичностью, низкой температурой плавления, отсутствием полиморфизма.
- 11. Цветные подразделяются:Легкие металлы - Be, Mg, Al
- 12. Нахождение металлов в природеВ самородном состоянии: Cu,
- 13. Кристаллические структуры металлов1. Объемноцентрированная кубическая решетка (ОЦК)(Na,
- 14. 2. Гранецентрированная кубическая решетка (ГЦК).Решетка куба с
- 15. 3. Гексагональная решетка с гексагональной плотной упаковкой
- 16. Полиморфизмα – модификация устойчива при сравнительно низких
- 17. Физические свойства металлов1. Твердость (кроме Hg)Самый твердый
- 18. 4. ПлотностьОт 0,53 Li до 22,5 г/см3
- 19. 6. Магнитные свойства a) Диамагнитные(в основном амфотерные Ме:
- 20. Получение металловПирометаллургия Восстановители: уголь, оксида углерода (II)
- 21. — Сульфидные руды 2ZnS + 3О2 =
- 22. ГидрометаллургияРуда → раствор CuO + Н2SО4 =
- 23. Электролиз раствора2CuSO4 + 2H2O
- 24. ПОЛУЧЕНИЕ МЕТАЛЛОВ ВЫСОКОЙ ЧАСТОТЫ1. Электролитическое рафинирование(Ag, Cu,
- 25. 3. Химические транспортные реакции Карбонильный способ (Ni,
- 26. 4. Зонная плавка(Ge, W, Mo) до чистоты 10-8 %
- 27. ХИМИЧЕСКИЕ СВОЙСТВА Me ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИС
- 28. С водородом.Взаимодействуют щел. и щел.-зем. металлы:Ca (Sr,
- 29. С серой.2Ag + S = Ag2S2-
- 30. С другими неметаллами.Из металлов I группы с
- 31. 2. ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ С водой.Металлы
- 32. 2) C кислотами.Все металлы, расположенные в ряду
- 33. 3) Со щелочами.Взаимодействуют амфотерные металлы (Zn, Al,
- 34. С концентрированной серной кислотой реакции идут по схеме:Сu + 2Н2SO4(конц) = СuSO4 + SO2↑ + 2Н2О
- 35. Скачать презентацию
- 36. Похожие презентации
































Слайд 2
Общие свойства металлов
обусловлены:
- Строением атома
- Наличием кристаллической решетки
-
Наличием металлической связи
Слайд 4
s-металлы: элементы IA и IIA групп.
Свойства s-металлов:
– постоянные
валентности или степени окисления (+1 и +2);
– основной характер
оксидов, за исключением бериллия. Расположение металлов в периодической системе
Д.И. Менделеева
Слайд 5 p-металлы: элементы IIIA (кроме бора B), IVA (германий
Ge, олово Sn, свинец Pb) и VA (сурьма Sb
и висмут Bi) групп.Свойства:
– образование химических связей осуществляется s- и p-электронами в процессе их возбуждения и гибридизации орбиталей;
– оксиды p-металлов проявляют амфотерный характер;
– основные оксиды образуют только p-элементы IIIA группы пятого и шестого периодов – индий In и таллий Tl.
Слайд 6 d-металлы: 30 элементов, расположенных в серединах периодов (IV,
V, VI, VII) и достраивающих d-подуровень предпоследнего слоя при
уже заполненном внешнем ns-подуровне.Свойства:
– в образовании химических связей у атомов d-металлов могут принимать участие как s-, так и d-электроны. Все d-элементы, кроме Zn и Cd, обладают переменной степенью окисления;
– характер оксидов d-металлов зависит от степени окисления: оксиды низшей степени окисления имеют основной характер, средней - амфотерный, высшей – кислотный.
Слайд 7 f-металлы: лантаноиды и актиноиды. У этих элементов достраиваются
энергетические подуровни 4f и 5f при заполненном внешнем уровне
6s2 и 7s2.Сложное строение электронных оболочек f-металлов сказывается на их свойствах:
– f-металлы проявляют устойчивую степень окисления +3, при возбуждении возможны и более высокие степени окисления;
– f-металлы обладают высоким сродством к кислороду и образуют устойчивые оксиды типа R2O3.
Слайд 8
Черные металлы
Черные металлы характеризуются темно-серым цветом, большой плотностью
(кроме щелочноземельных Ме), высокой температурой плавления, относительно высокой твердостью,
часто имеют - полиморфизм.
Слайд 9
Черные подразделяются:
Железные металлы - Fe, Co, Ni (ферромагнетики)
и Mn.
Тугоплавкие металлы - температура плавления выше Fe
(1539оС) - добавки легированных сталей и основы для соответствующих сплавов.Урановые металлы - актиниды - для сплавов атомной энергетики.
Редкоземельные металлы (РЗМ) – лантан , церий, неодим, празеодим и др. - лантаноиды + иттрий и скандий. Близки по химическим, различаются по физическим свойствам. Присадки к сплавам других элементов.
Щелочноземельные металлы. В свободном состоянии применяются в особых случаях (теплоносители в атомных реакторах).
Слайд 10
Цветные металлы
Цветные металлы характеризуются: характерной окраской (красная, желтая,
белая), большой пластичностью, низкой температурой плавления, отсутствием полиморфизма.
Слайд 11
Цветные подразделяются:
Легкие металлы - Be, Mg, Al -
малая плотность.
Благородные металлы - Ag, Au, платиновая группа (Pt,
Pd, Ir (иридий), Rh (родий), Os (осмий), Ru (рутений)), "полублагородная" медь. Высокая устойчивость против коррозии.Легкоплавкие металлы - Zn, Cd, Hg, Sn, Pb, Bi, Tl (таллий), Sb (сурьма), элементы с ослабленными металлическими свойствами: Ga (галлий), Ge (германий).
Слайд 12
Нахождение металлов в природе
В самородном состоянии: Cu, Ag,
Hg, Pt, Au
В виде соединений: оксидные (Fe3O4 –
магнетит), карбонатные (CaCO3 – известняк),
фосфатные, силикатные,
алюмосиликатные (K2O×Al2O3×6SiO2 – полевой шпат или ортоклаз),
сульфидные (HgS – киноварь) и галидные
(NaCl – галит, каменная или поваренная соль).
Слайд 13
Кристаллические структуры металлов
1. Объемноцентрированная кубическая решетка (ОЦК)
(Na, K,
α-Fe, δ-Fe, V, Cr, Mo, W)
координационное число: к.ч. =
8плотность упаковки: ρ = 68 %
Слайд 14
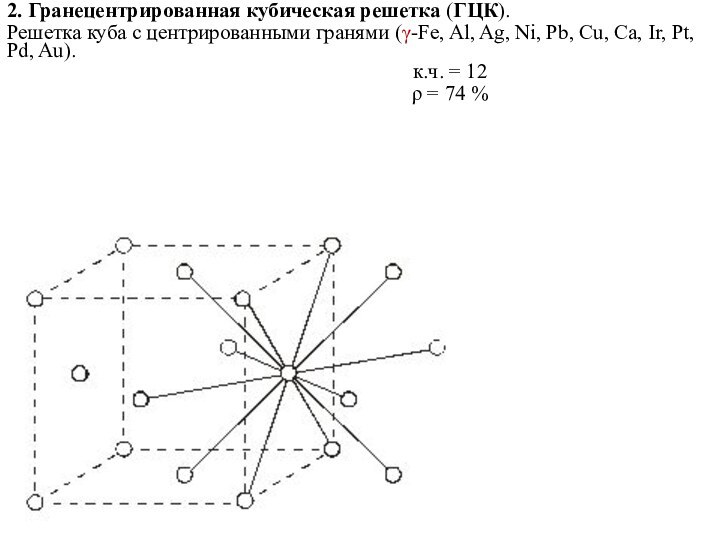
2. Гранецентрированная кубическая решетка (ГЦК).
Решетка куба с центрированными
гранями (γ-Fe, Al, Ag, Ni, Pb, Cu, Ca, Ir,
Pt, Pd, Au).к.ч. = 12
ρ = 74 %
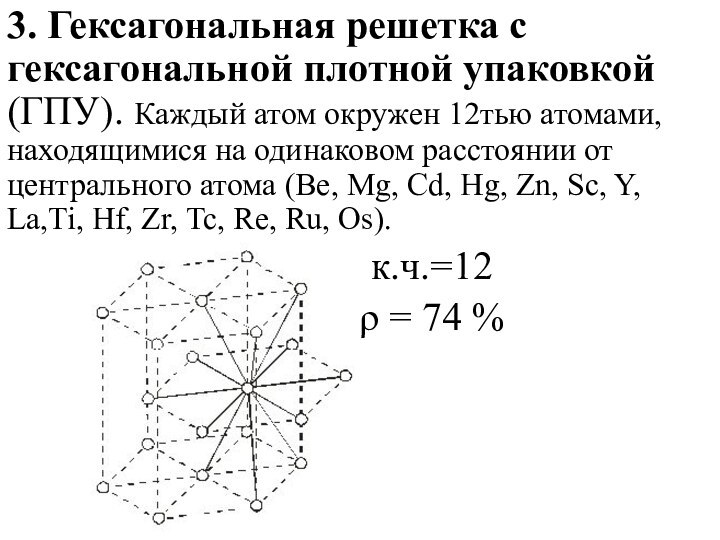
Слайд 15 3. Гексагональная решетка с гексагональной плотной упаковкой (ГПУ).
Каждый атом окружен 12тью атомами, находящимися на одинаковом расстоянии
от центрального атома (Be, Mg, Cd, Hg, Zn, Sc, Y, La,Ti, Hf, Zr, Tc, Re, Ru, Os).к.ч.=12
ρ = 74 %
Слайд 16
Полиморфизм
α – модификация устойчива при сравнительно низких температурах,
β – устойчива при более высоких температурах.
Например, железо может
существовать в виде четырех полиморфных модификаций α−, β−, γ−, δ−Fe. Модификации α−, β−, δ−Fe отличаются друг от друга температурными интервалами устойчивости и магнитными свойствами, но имеют одинаковую объемноцентрированную кубическую решетку.
Модификация γ−Fe, устойчивая в интервале 910-1401°С, имеет гранецентрированную кубическую решетку.
Слайд 17
Физические свойства металлов
1. Твердость (кроме Hg)
Самый твердый Cr.
Самые мягкие – щелочные.
3. Температура плавления
t > 1000оC
тугоплавкиеt < 1000оC легкоплавкие
tпл (Hg) = –39оС; tпл (W) = 3420оС
2. Непрозрачность/металлический блеск
Все металлы серого цвета, кроме Cu, Cs, Au.
Al и Mg имеют блеск в порошкообразном состоянии.
Слайд 18
4. Плотность
От 0,53 Li до 22,5 г/см3 Os
ρ
< 5 г/см3 – легкие металлы (щелочные, щелочно-земельные, Be,
Al, Sc, Y, Ti).ρ > 5 г/см3 – тяжелые металлы
5. Пластичность (ковкость)
Au, Ag, Cu, Sn, Pb, Zn, Fe
уменьш.
Из 1 г золота можно вытянуть проволоку длиной 34,2 м. Можно получить золотую фольгу толщиной 0,0001 мм, что в 500 раз тоньше волоса).
Слайд 19
6. Магнитные свойства
a) Диамагнитные
(в основном амфотерные Ме: Be,Zn,Ga,Ge)
б)
Парамагнитные
в) Ферромагнитные (Fe, Co, Ni)
7. Высокая тепло- и электропроводность
Наибольшая
Ag, CuНаименьшая Pb, Hg
Слайд 20
Получение металлов
Пирометаллургия
Восстановители: уголь, оксида углерода (II) или
водород.
— С или СО
ZnО + С = Zn +
СО
Fе2О3 + 3СО = 2Fе + 3СО2— H2
WO3 + 3H2 =W + 3H2O СоО + Н2 = Со + Н2О
Слайд 21
— Сульфидные руды
2ZnS + 3О2 = 2ZnО
+ 2SО2
ZnО + С = СО + Zn
Металлотермия
— алюминотермия
4Аl + 3МnО2 = 2А12О3 + 3Мn
— магнийтермия
TiCl4 + 2Mg = 2MgCl2 + Ti (Mn, Cr, Ti, Мо, W)
Слайд 22
Гидрометаллургия
Руда → раствор
CuO + Н2SО4 = CuSО4
+ Н2О
CuSО4 + Fe
= FeSO4 + CuЭлектрометаллургия
Электролиз расплава:
NaCl расплав Na + Cl2↑
К(–): Na+ А(+): Cl–
Na++ ē → Na 2Cl– – 2ē → Cl2↑
Слайд 23
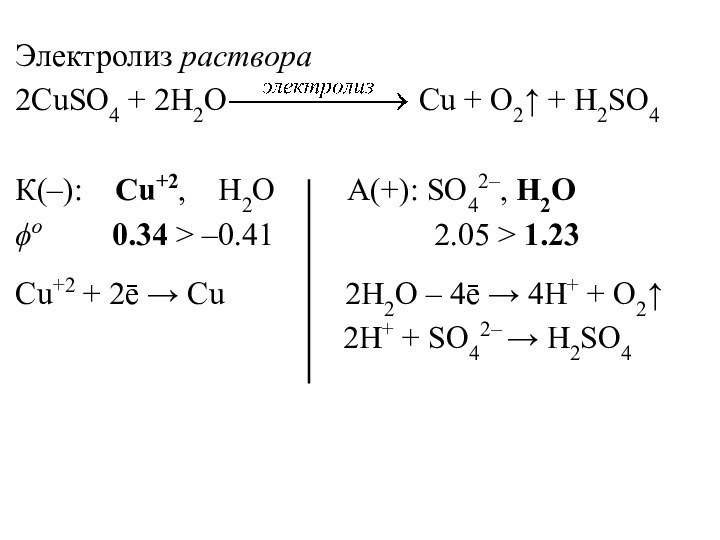
Электролиз раствора
2CuSO4 + 2H2O
Cu + O2↑ + H2SO4
К(–): Cu+2, H2O А(+): SO42–, H2O
ϕо 0.34 > –0.41 2.05 > 1.23
Cu+2 + 2ē → Cu 2H2O – 4ē → 4H+ + O2↑
2H+ + SO42– → H2SO4
Слайд 24
ПОЛУЧЕНИЕ МЕТАЛЛОВ ВЫСОКОЙ ЧАСТОТЫ
1. Электролитическое рафинирование
(Ag, Cu, Fe,
Ni, Pb)
2. Перегонка и переплавка в вакууме
(W, Mo, Re)
Слайд 25
3. Химические транспортные реакции
Карбонильный способ (Ni, Fe)
Ni
+ 4CO Ni(CO)4
(t = 42°C)тетракарбонил Ni
Fe + 5CO Fe(CO)5 (t = 105°C)
пентакарбонил Fe
Йодидный способ (Ti, Zr)
Ti(загрязненный) + 2I2 TiI4 (t = 100-200°C)
TiI4 Ti(чистый) + 2I2 (t = 1500°C)
Слайд 27
ХИМИЧЕСКИЕ СВОЙСТВА Me
ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
С кислородом.
Все,
кроме Pt, Pd, Au.
4Li + O2 = 2Li2O оксид
лития2Cu + O2 = 2CuO оксид меди
Слайд 28
С водородом.
Взаимодействуют щел. и щел.-зем. металлы:
Ca (Sr, Ba)
+ H2 = CaH2 (SrH2, BaH2)
гидриды
Гидриды щелочных металлов малоустойчивы,
обладают восстановительными свойствами.
Слайд 30
С другими неметаллами.
Из металлов I группы с азотом,
углеродом, кремнием непосредственно взаимодействует только литий:
6Li + N2 =
2Li3N (250°C) нитрид лития2Li + 2C = Li2C2 (600°C) карбид лития
4Li + Si = Li4Si (600-700°C, примесь Li2Si)
Металлы II группы:
Са + С = СаС2 карбиды
3Mп + N2 = Mg3N2 нитриды
t
t
Слайд 31
2. ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ
С водой.
Металлы I
группы: Na + H2O = NaOH + ½ H2↑
При
переходе от Li к Cs интенсивность реакции увеличивается, цезий взаимодействует с водой наиболее бурно.Металлы II группы: Ca + 2H2O = Ca(OH)2 + H2↑
Be и Mg взаимодействуют медленно из-за обволакивания металлов образующимися гидроксидами.
Слайд 32
2) C кислотами.
Все металлы, расположенные в ряду напряжений
до водорода вытесняют его из разбавленных кислот, кроме азотной
кислоты:2HClразб.+ Zn = ZnCl2 + H2↑
H2SO4разб.+ Fe = FeSO4 + H2↑
С конц. H2SO4 и разб. и конц. HNO3 взаимодействуют все Ме, кроме Au и Pt.
8Al + 30HNO3 = 8Al(NO3)3+3NH4NO3+9H2O
Слайд 33
3) Со щелочами.
Взаимодействуют амфотерные металлы (Zn, Al, Pb,
Sn, Be, Cr(III)).
Zn + 2NaOH + 2Н2О = Na2[Zn(OH)4]
+ H2↑2Al+6NaOH+6Н2О = 2Na2[Al(OH)6]+3H2↑