- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Урок химии в 9 классе Железо и его соединения
Содержание
- 2. Положение железа в ПСХЭ Д.И. Менделеева. Строение атома железа
- 3. Строение атома железа
- 4. Природные соединения железаПо распространенности в земной коре
- 5. Магнитный железняк
- 6. Магнитный железняк
- 7. Красный железняк
- 8. Красный железняк
- 9. Бурый железняк
- 10. Бурый железняк
- 11. Серный колчедан (пирит)
- 12. Серный колчедан (пирит)
- 13. Роль железа в организме человекаОрганизм взрослого человека
- 14. Физические свойства железаСеребристо-белый блестящий металлТ пл. =
- 18. Химические свойства железа1. Взаимодействие с простыми веществамиВзаимодействие
- 19. 2. Взаимодействие железа со сложными веществамиВзаимодействие с
- 20. 2. Взаимодействие железа со сложными веществамиВзаимодействие с
- 21. Получение железа из его соединений Запишите
- 22. Применение железа
- 25. Соединения железа
- 26. Соединения железа (II)FeO – оксид железа (II),основный
- 27. Соединения железа (III)Fe2O3 – оксид железа (III),
- 28. Fe (OH)3 – гидроксид железа (III)красновато-коричневое кристаллическое
- 29. Качественные реакции на железо (II) FeSO4
- 30. Скачать презентацию
- 31. Похожие презентации
Положение железа в ПСХЭ Д.И. Менделеева. Строение атома железа


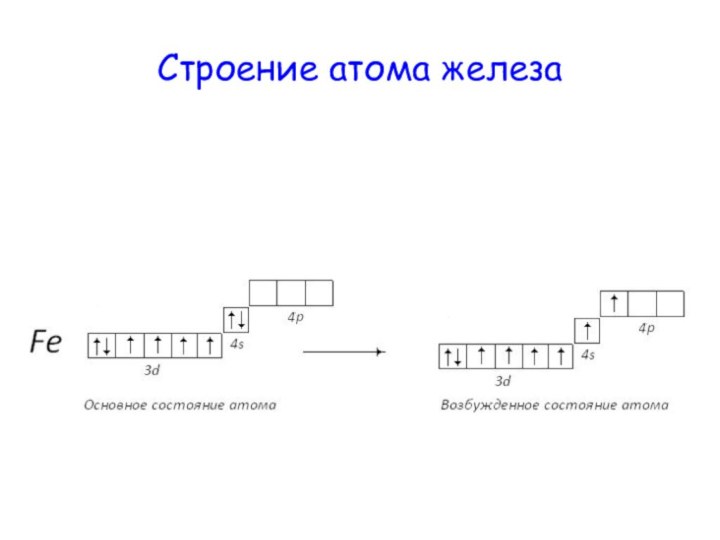



























Слайд 4
Природные соединения железа
По распространенности в земной коре Fe
занимает 4 место после O, Si и Al
Магнитный железняк
(магнетит) Fe3О4Красный железняк (гематит) Fe2О3
Бурый железняк (лимонит) 2Fe2О3*3Н2О
Железный, серный колчедан (пирит) FeS2
Слайд 13
Роль железа в организме человека
Организм взрослого человека содержит
около 3 г железа, из которых приблизительно 75 %
входит в состав гемоглобина.Основной функцией этой части железа является связывание молекулярного кислорода и перенос его в ткани.
При недостатке железа в организме человек быстро начинает утомляться, возникают головные боли, появляется плохое настроение.
https://www.youtube.com/watch?v=zZYnomntyDg
Слайд 14
Физические свойства железа
Серебристо-белый блестящий металл
Т пл. = 1539°С.
Очень
пластичный металл, легко обрабатывается.
Железо способно намагничиваться и размагничиваться.
Технически чистое
железо – низкоуглеродистая сталь (0,02-0,04% С)Химически чистое железо содержит менее 0,01% примесей
Слайд 18
Химические свойства железа
1. Взаимодействие с простыми веществами
Взаимодействие с
галогенами https://www.youtube.com/watch?v=XCgk9psIqo8
Fe + Cl2 →
Горение железа
в кислородеhttps://www.youtube.com/watch?v=o9Rvc3Vae_c
Fe + О2 →
Взаимодействие железа с серой https://www.youtube.com/watch?v=jzEnZ6B7xNA
Fe + S →
t
t
t
Слайд 19
2. Взаимодействие железа со сложными веществами
Взаимодействие с растворами
кислот
https://www.youtube.com/watch?v=1k5HFUWmaik
Fe + H2SO4 →
Fe +
HCl →Взаимодействие с концентрированными азотной и серной кислотами
https://www.youtube.com/watch?v=lziguDQbDH0
Fe + H2SO4 →
Fe + HNO3 →
https://www.youtube.com/watch?v=ytFfF6WwMyg Пассивация железа в конц. азотной кислоте
конц.
конц.
Слайд 20
2. Взаимодействие железа со сложными веществами
Взаимодействие с парами
воды при высокой температуре (700-900°C)
Fе + Н2O
→Коррозия железа
Fе + O2 + Н2O →
https://www.youtube.com/watch?v=kejU-kgnai4
Взаимодействие с солями менее активных металлов
Fe + CuSO4 → https://www.youtube.com/watch?v=Xm5RB0qljQo
Слайд 21 Получение железа из его соединений Запишите уравнения реакций, расставьте
коэффициенты
Fe2O3 + H2 → Fe + H2O
Алюмотермия ttps://www.youtube.com/watch?v=QoGEZw_C9nY
Fe2O3 + Al → Fe + Al2O3Fe2O3 + C → Fe + CО
Fe2O3 + CO → Fe + CО2
t
t
t
t
Слайд 26
Соединения железа (II)
FeO – оксид железа (II),
основный оксид
чёрного цвета
FeO + HCl →
FeO + N2O5 →
Fe (OH)2
– гидроксид железа (II), https://www.youtube.com/watch?v=7MbFmUpIkrgслабое основание, растворимое в сильных кислотах:
Fe(OH)2 + H2SO4 →
Fe(OH)2 →
t
Слайд 27
Соединения железа (III)
Fe2O3 – оксид железа (III),
амфотерный
оксид
с преобладанием основных свойств
красно-бурый порошок, нерастворимый
в воде.Fe2О3 + HNO3 →
Получение:
Fe(OH)3 →
FeS2 + O2 →
t
t
Слайд 28
Fe (OH)3 – гидроксид железа (III)
красновато-коричневое кристаллическое вещество,
не растворяется в воде.
Получение гидроксида железа (III) и взаимодействие
его с кислотами https://www.youtube.com/watch?v=3PLcEj3F1Z8
Fe(NO3)3 + NaOH →
Fe(OH)3 + HCl →





























