- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Оксиды. Классификация и химические свойства оксидов (8 класс)
Содержание
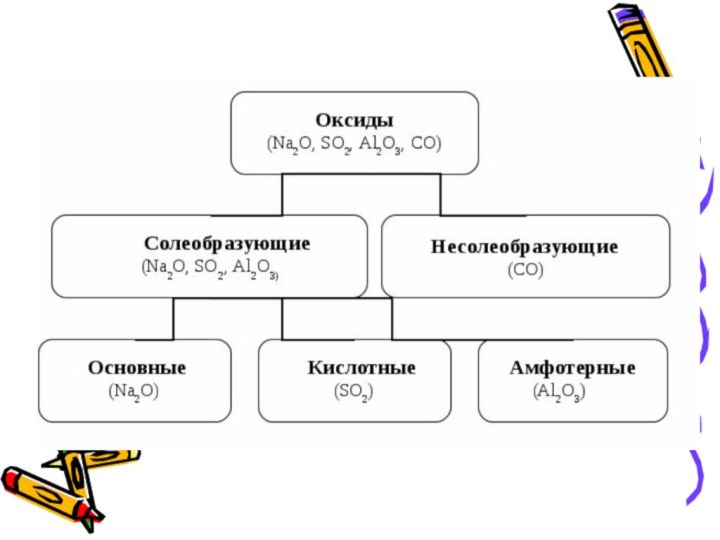
- 2. Оксиды-это сложные вещества, которые состоят из двух
- 5. Несолебразующими называют такие оксиды, которые не взаимодействуют
- 6. Солеобразующими называются оксиды, которые взаимодействуют
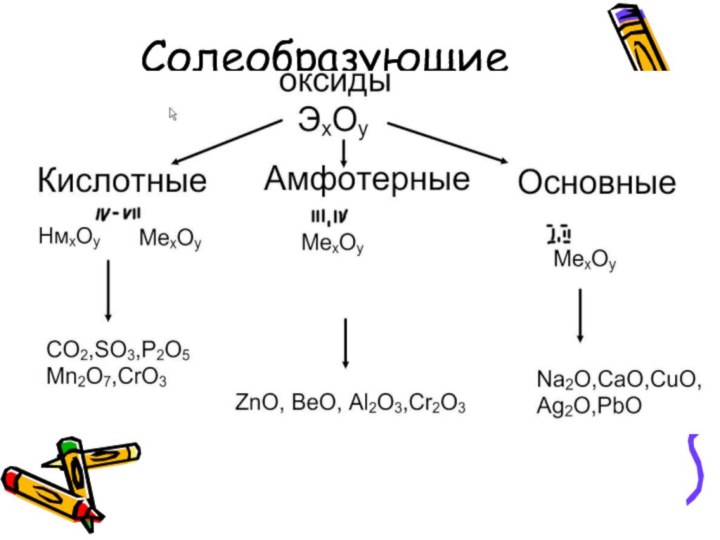
- 7. Солеобразующие оксиды:
- 8. Кислотные оксиды-это такие оксиды, которым соответствуют кислоты
- 9. Нерастворимый в воде кислотный оксид SiO2
- 10. Типичные реакции кислотных оксидовКислотный оксид + щёлочь→соль
- 11. Основные оксиды-это такие оксиды, которым соответствуют основания
- 12. Типичные реакции основных оксидовОсновный оксид + кислота→соль
- 13. Общие свойства оксидов:Основный оксид + кислотный оксид→
- 14. Задания для закрепления изученной темы:1).Какие из перечисленных
- 15. Задание 3:Осуществить следующие превращение: алюминий→оксид алюминия →гидроксид алюминия→бромид алюминия→алюминий.Напишите уравнения реакций.
- 16. Выводы:1)повторили определение «оксидов»,2)рассмотрели классификацию оксидов по агрегатному
- 17. Домашнее задание:Учить параграф №30, упр.1,3,5 стр.92
- 18. Скачать презентацию
- 19. Похожие презентации
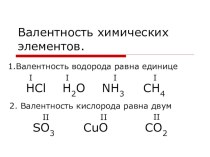
Оксиды-это сложные вещества, которые состоят из двух элементов, одним из которых является кислород. Общая формула оксидов: ЭnOm
















Слайд 2 Оксиды-это сложные вещества, которые состоят из двух элементов,
одним из которых является кислород.
Слайд 5 Несолебразующими называют такие оксиды, которые не взаимодействуют ни
с кислотами, ни с щелочами и не образуют солей.
Примеры
несолеобразующих оксидов: NO; N2O; CO; SiO.Слайд 6 Солеобразующими называются оксиды, которые взаимодействуют с
кислотами или с щелочами с образованием соли и воды.
Слайд 8 Кислотные оксиды-это такие оксиды, которым соответствуют кислоты (оксиды
неМе или металлов с валентностью 3-7)
CO2 - H2CO3
SO2-H2SO3
Mn2O7-HMnO4
Слайд 10
Типичные реакции кислотных оксидов
Кислотный оксид + щёлочь→соль +
вода (реакция обмена).
SO3+2KOH→K2SO4+H2O
CO2+Ca(OH)2→CaCO3+H2OКислотный оксид + вода→кислота
(реакция соединения)
SO3 +H2O→H2SO4
Слайд 11 Основные оксиды-это такие оксиды, которым соответствуют основания (Ме
с валентностью- 1 и 2)
K2O – KOH
BaO- Ba(OH)2Li2O-LiOH SrO-Sr(OH)2
Слайд 12
Типичные реакции основных оксидов
Основный оксид + кислота→соль +
вода
(реакция обмена)CuO + H2SO4→CuSO4 + H2O
K2O +2HCl→2KCl + H2O
Основный оксид + вода→щёлочь
(реакция соединения)
K2O + H2O→2KOH
Ca O + H2O→Ca(OH)2
Слайд 13
Общие свойства оксидов:
Основный оксид + кислотный оксид→ соль
(реакция соединения)
Li2O + CO2 → Li2CO3SO2 + MgO → MgSO3
Слайд 14
Задания для закрепления изученной темы:
1).Какие из перечисленных веществ
являются оксидами?
КОН; SiO2; H2SO4; CaO; NaCl; N2O3; Fe2O3; Zn(OH)2;
Al2O3.2)Какие из перечисленных веществ являются основными и кислотными оксидами? Дать им названия.
Li2O; SO3; FeO; Mn2O7;CO2; BaO; SiO2