- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Урок по химии на тему
Содержание
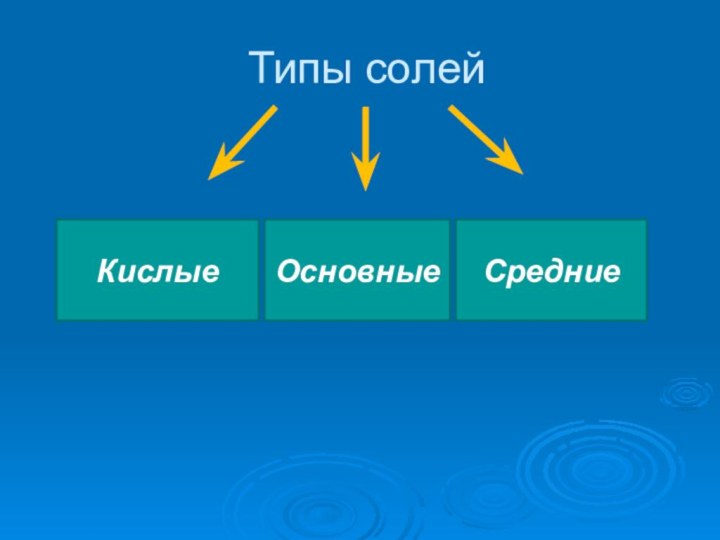
- 2. Типы солейОсновныеКислыеОсновныеСредние
- 3. Выберете средние, кислые, основные соли, дайте им
- 4. Определите среду раствора в следующих солях:1. Сульфата
- 5. Дать названия солям.NaHCO3, CaOHCL, (ВаOH)2SO4, AI(H2PO4)3, Fe(OH)2Br.Напишите уравнение их диссоциации.К какому типу солей она относится?
- 6. Среда раствораКислая – дает соль, образованная сильной
- 7. Изменение цвета индикаторов в разных средах.
- 8. Гидролиз – это разложение соли водой.
- 9. Кислоты диссоциируют на ионы водорода и кислотного
- 10. Основания диссоциируют на ионы металла и гидроксид-ионы Na OH = Na+ + OH-Ca(OH)2 = Ca2++2OH-
- 11. Гидролизу подвергаются соли образованные: 1.Сильным основанием и
- 12. Соль образованная сильной кислотой и сильным основанием - Гидролизу не подвергается.
- 13. Сильные кислоты:HCI , HI , H Br ,HNO3 , H2SO4 , HCIO4.Сильные основания:Все щелочи.
- 14. Даны три соли: Хлорид натрия, карбонат калия,
- 15. NaClОснование сильное = Кислота сильнаяСреда нейтральная
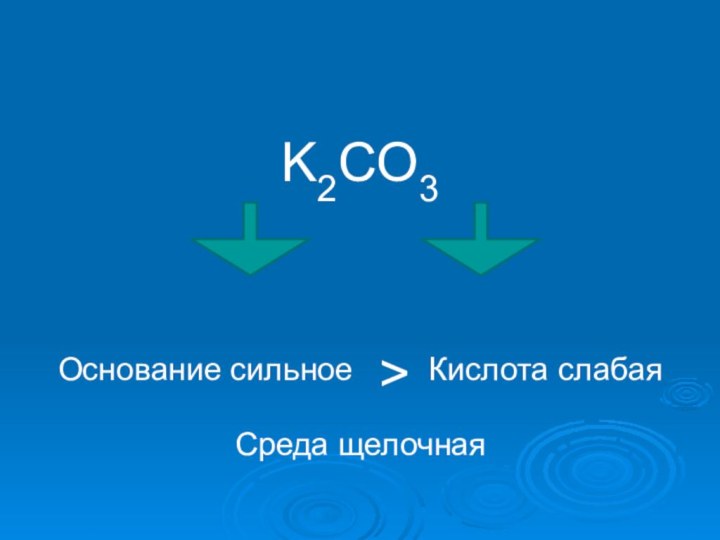
- 16. K2CO3Основание сильное > Кислота слабаяСреда щелочная
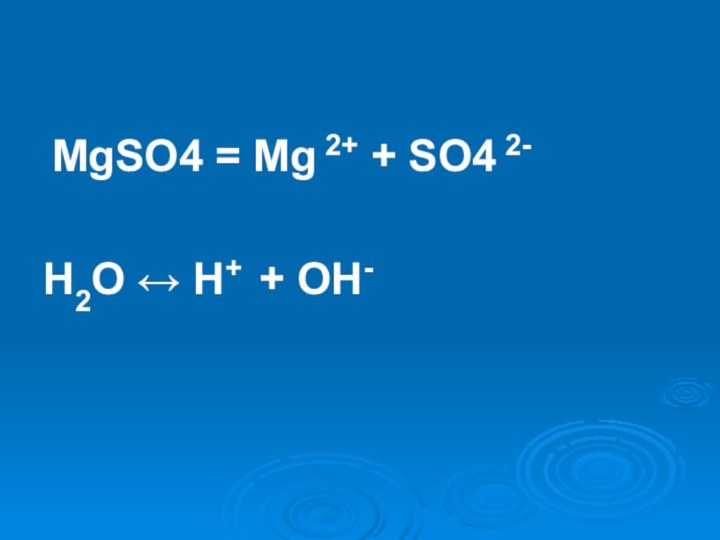
- 17. MgSO4Слабое основание < Сильная кислотаСреда кислая
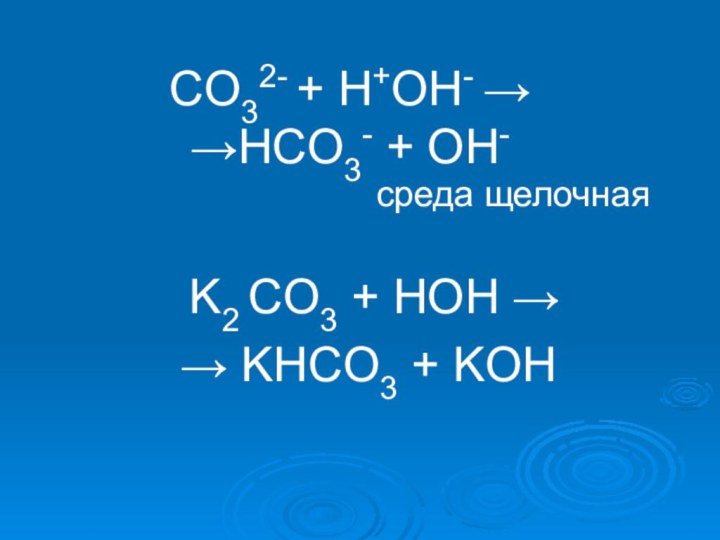
- 18. K2CO3 = 2K + + CO3 2-H2O ↔ H+ + OH-
- 19. СO32- + H+OH- → →HСO3- + OH-
- 20. MgSO4 = Mg 2+ + SO4 2-H2O ↔ H+ + OH-
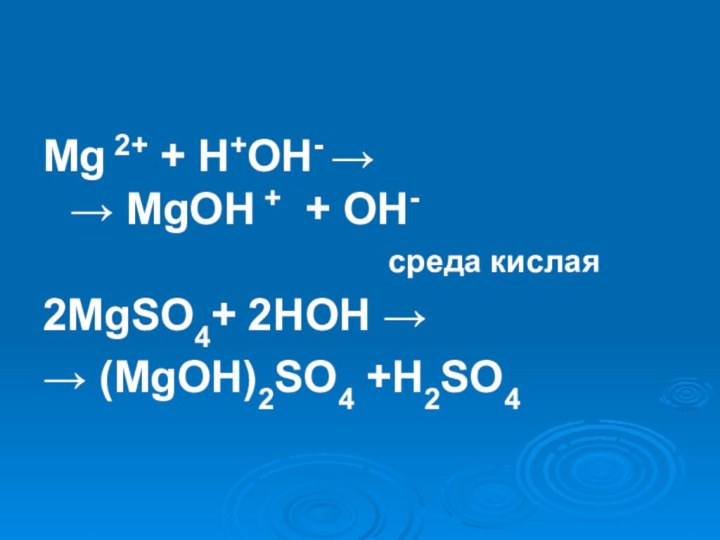
- 21. Mg 2+ + H+OH- → → MgOH
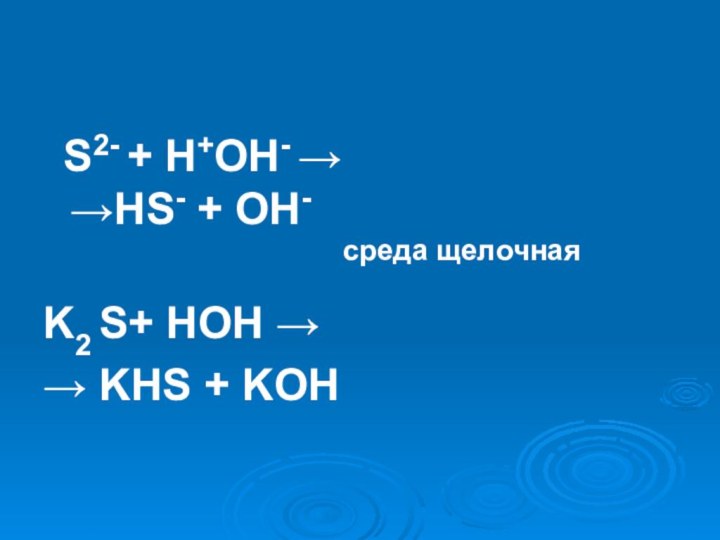
- 22. K2S = 2K + + S2-H2O ↔ H+ + OH-
- 23. S2- + H+OH- → →HS-
- 24. Гидролиз каких солей идет по анионуAlBr3 ; K2S; FeCl2; CoSO4; Na2SO3;
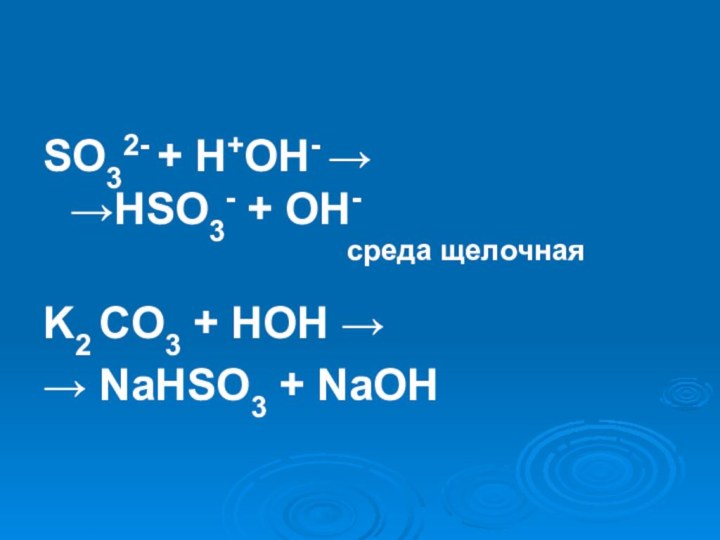
- 25. Na2SO3 = Na+ + SO3 2-H2O ↔ H+ + OH-
- 26. SO32- + H+OH- → →HSO3- + OH-
- 27. Скачать презентацию
- 28. Похожие презентации
Типы солейОсновныеКислыеОсновныеСредние



















Слайд 4
Определите среду раствора в следующих солях:
1. Сульфата бария
2.
Хлорида натрия
3. Сульфида алюминия
4. Нитрата магния
5. Карбоната калия
6. Хлорида
цинка7. Сульфида натрия
Слайд 5
Дать названия солям.
NaHCO3, CaOHCL, (ВаOH)2SO4, AI(H2PO4)3, Fe(OH)2Br.
Напишите уравнение
их диссоциации.
К какому типу солей она относится?
Слайд 6
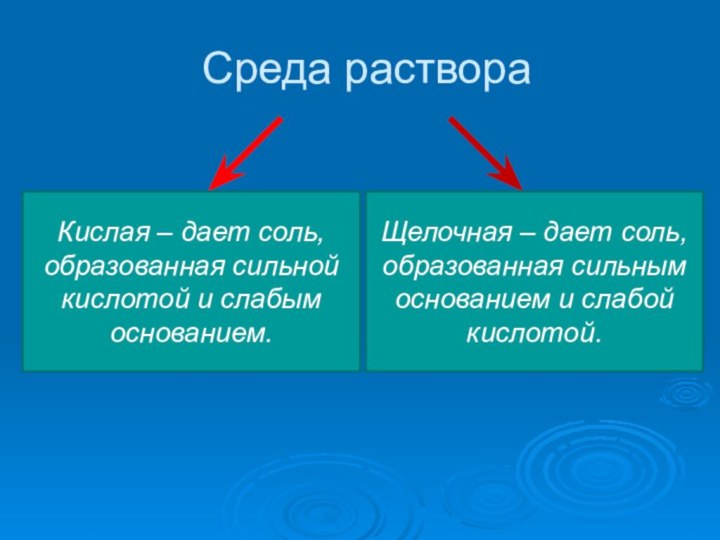
Среда раствора
Кислая – дает соль, образованная сильной кислотой
и слабым основанием.
Щелочная – дает соль, образованная сильным основанием
и слабой кислотой.Слайд 9 Кислоты диссоциируют на ионы водорода и кислотного остатка.
HCI = Н+ + CI ‾
H2SO4 = 2H+ + SO4 2‾