и положениями ТЭД.
2. Отработать умения характеризовать
свойства вещества
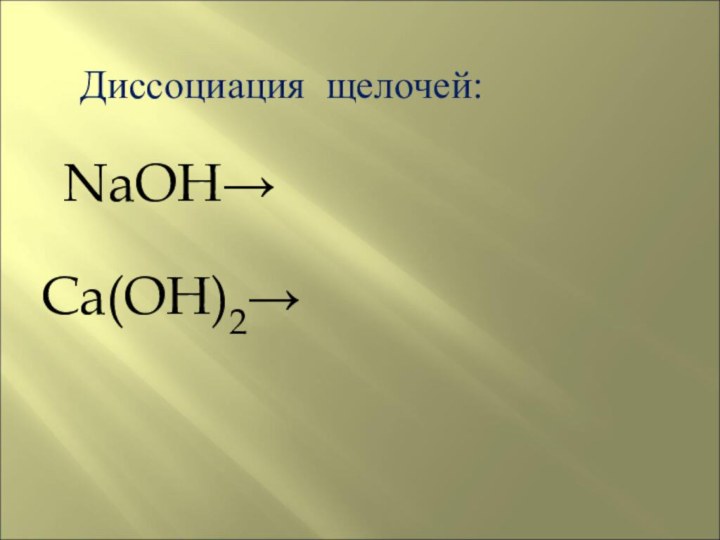
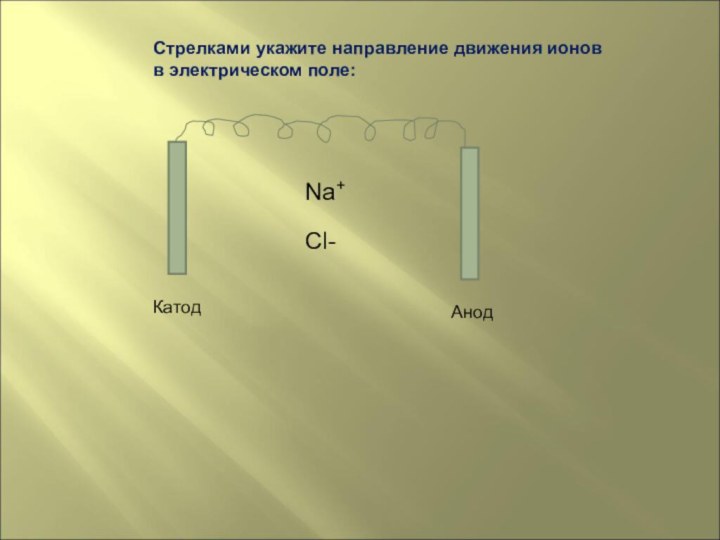
на основе его строения,составлять схемы диссоциации электролитов.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть














В.А. Кистяковский – русский
химик. Объединил ТЭД
с теорией растворов
Д.И. Менделеева.
… H+ + HPO4 2-
… H+ + H2 PO4 –
… H+ + PO4 3-