положению в ПС;
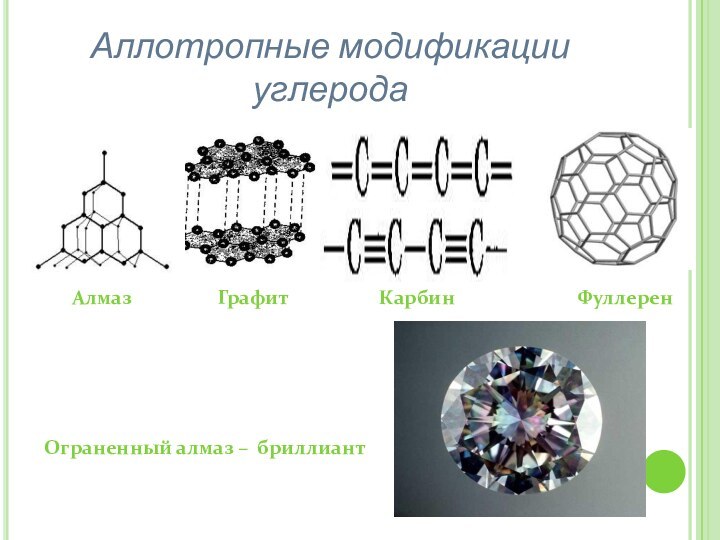
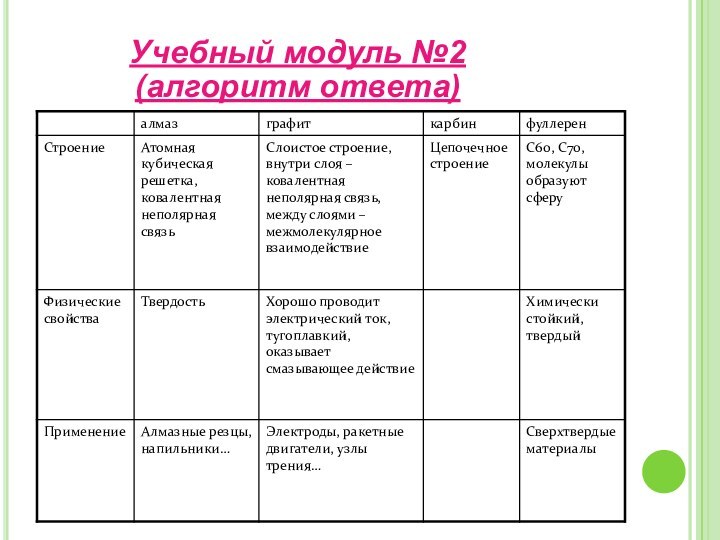
– изучить аллотропные модификации углерода;
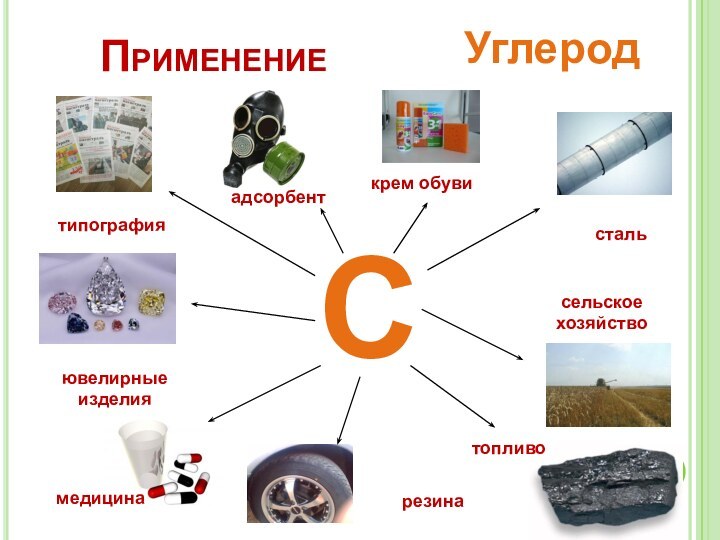
– изучить химические
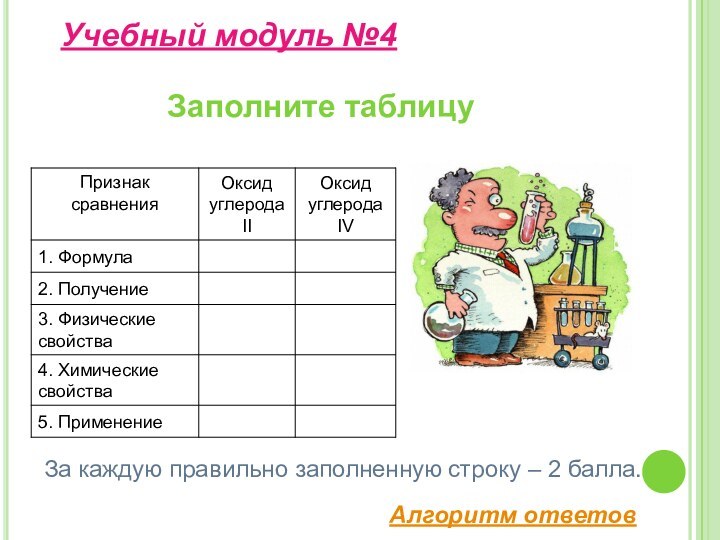
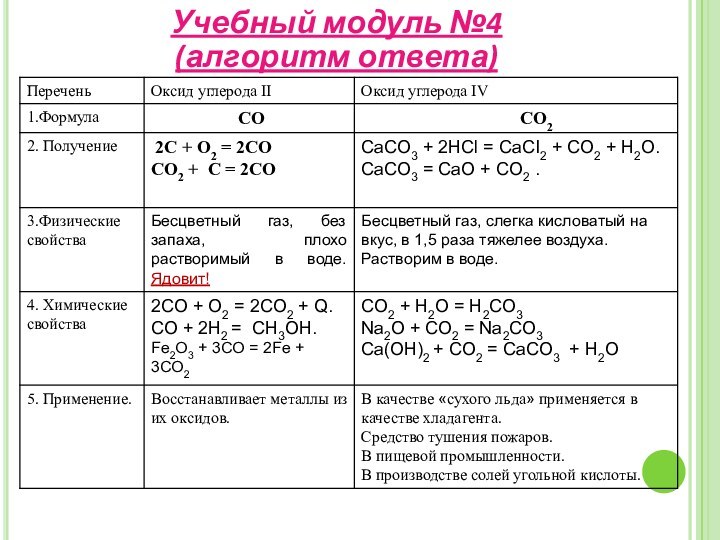
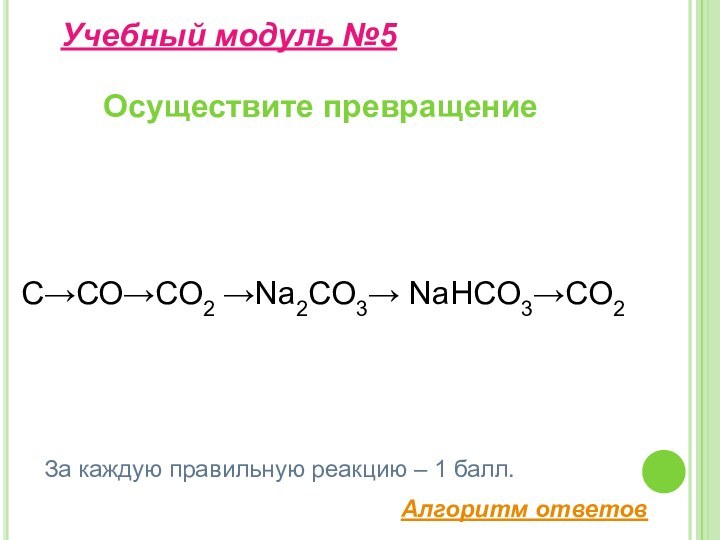
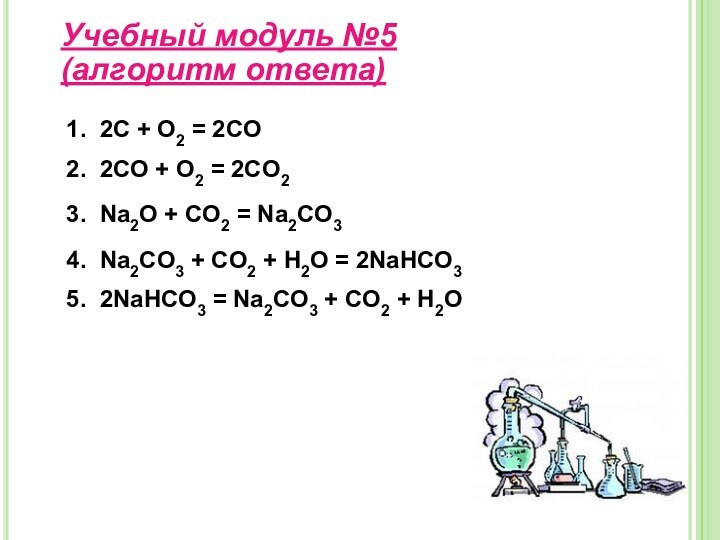
свойства и применение углерода;– изучить строение, свойства, получение и применение оксидов углерода II, IV;
– изучить строение, свойства и применение угольной кислоты.