- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химиялық байланыстар
Содержание
- 2. ХИМИЯЛЫҚ БАЙЛАНЫСХимиялық байланыс дегеніміз молекулаларда және кристалдық
- 3. Бірінші рет электронды бұлттың құрылысын түсіндірген Бор
- 4. ХИМИЯЛЫҚ БАЙЛАНЫСТАРДЫҢ ТҮРЛЕРІ ЖӘНЕ НЕГІЗГІ ЕРЕКШЕЛІКТЕРІ
- 5. КОВАЛЕНТТІ БАЙЛАНЫСЕкі атом арасында химиялық байланыс электрон жұбы ортақтасуы арқылы түзілсе, ол ковалентті байланыс деп аталады.
- 7. ЭЛЕМЕНТТЕРДІҢ САЛЫСТЫРМАЛЫ ЭЛЕКТРТЕРІСТІЛІГІ
- 11. АТОМДЫҚ КРИСТАЛДЫҚ ТОР
- 12. МОЛЕКУЛАЛЫҚ КРИСТАЛДЫҚ ТОР
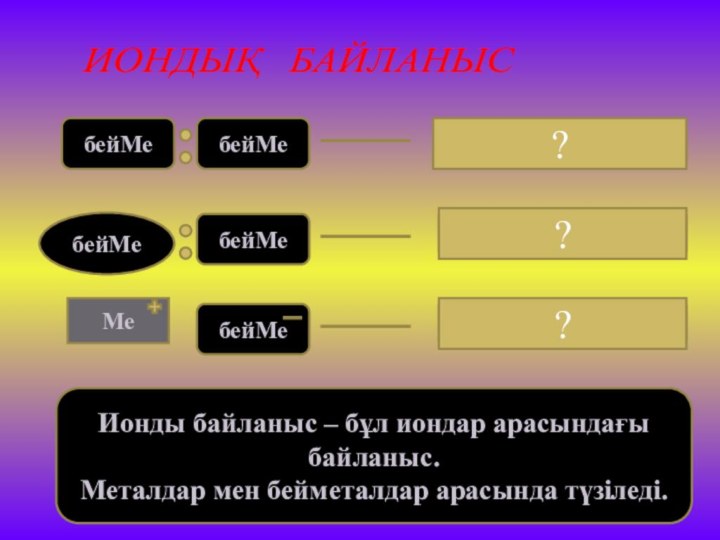
- 13. бейМебейМеКовалентті полюссіз байланысбейМебейМебейМеКовалентті полюсті байланысМеИонды байланыс???Ионды байланыс
- 15. Ион – бұл электрон беру немесе алу
- 16. Электрондарын беретін бөлшек оң ионға айналады (катион) Электрондарын беретін бөлшек теріс ионға (анион) айналады.
- 17. Na0 + F 0 → Na
- 19. Химиялық пирамиданың шыңына шығу жолы –
- 20. «Крестиктер-ноликтер» ойынын ойнаңдар. Барлығы ионды байланыспен түзілген
- 21. МЕТАЛДЫҚ БАЙЛАНЫС
- 22. МЕТАЛДЫҚ КРИСТАЛДЫҚ ТОРМеталдар мен олардың балқымалары металдық
- 23. СУТЕКТІК БАЙЛАНЫСТАРСутектік байланыстар – бір молекуладағы сутегі
- 24. Байланыстың түзілу механизмі :
- 25. Скачать презентацию
- 26. Похожие презентации




















Слайд 3 Бірінші рет электронды бұлттың құрылысын түсіндірген Бор жасаған
атом моделінің пайда болуы химиялық байланыс және оның электронды
құрылысы туралы түсініктің қалыптасуына әсер етті. Бор моделі бойынша электрондар атомда белгілі бір энергетикалық күйде, яғни энергетикалық деңгейде болады.. 1915 жылы неміс физигі Коссель тұздардағы химиялық байланысқа түсінік берді
.
1916 жылы американ ғалымы Льюис молекулалардағы химиялық байланысқа анықтама берді
. Коссель мен Льюис түсініктері валенттіліктің электрондық теориясы деген ат алды.
Слайд 5
КОВАЛЕНТТІ БАЙЛАНЫС
Екі атом арасында химиялық байланыс электрон жұбы
ортақтасуы арқылы түзілсе, ол ковалентті байланыс деп аталады.
Слайд 10
∙∙
∙∙∙H + ∙Cl ∙∙ → H ∙∙Cl∙∙
∙∙ ∙∙
Полюсті молекуладағы электрондар ығысқан кезде атомдар қосымша зарядқа ие бола бастайды.Молекуланың бір жағы оң, бір жағы теріс зарядталады.Мұндай молекулалар полюсті деп аталады. Коваленттік полюсті байланыс көбіне қышқылдар арасында болады.Мысалы HF ,H2 S, HNO3, H 2SO4, т.с.с
Слайд 13
бейМе
бейМе
Ковалентті полюссіз байланыс
бейМе
бейМе
бейМе
Ковалентті полюсті байланыс
Ме
Ионды байланыс
?
?
?
Ионды байланыс –
бұл иондар арасындағы байланыс.
Металдар мен бейметалдар арасында түзіледі.
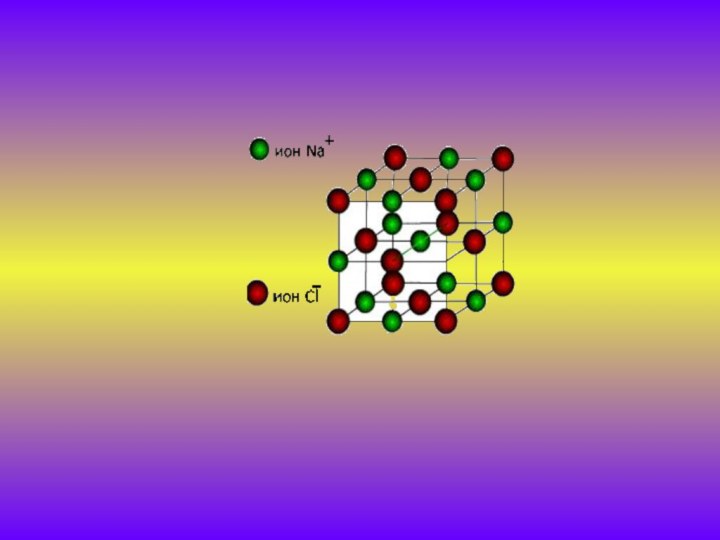
ИОНДЫҚ
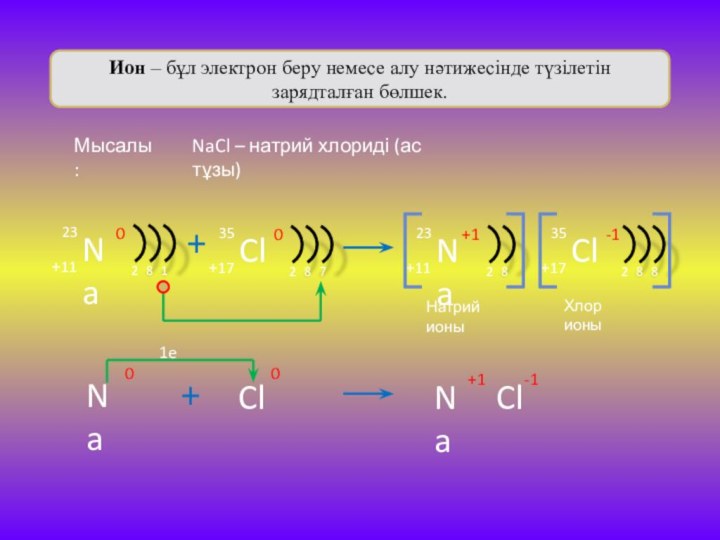
БАЙЛАНЫС Слайд 15 Ион – бұл электрон беру немесе алу нәтижесінде
түзілетін зарядталған бөлшек.
Мысалы:
NaCl – натрий хлориді (ас тұзы)
+
1e
Слайд 16
Электрондарын беретін бөлшек
оң ионға айналады (катион)
Электрондарын
беретін бөлшек
теріс ионға (анион) айналады.
Слайд 17
Na0 + F 0 → Na +
F-
Na0 + Cl02 → Na+ + Cl -
K 0 + Cl20 → K +Cl-
Zn0 + S0 → Zn +S-
қарама-қарсы зарядталған иондар арасындағы байланысты иондық байланыс деп атайды. 1916 жылы неміс ғалымы Коссель ұсынды. Өзінің сыртқы валенттік электрондарына сай электрон бұлтын берген атомдар оң зарядты катиондарға, ал осы электрондарға сай бұлтты қосып алған атомдар терісзарядты анионындарға айналады.Түзілген иондар біріне-бірі Кулон заңы бойынша тартылысып.иондық байланыс түзіледі
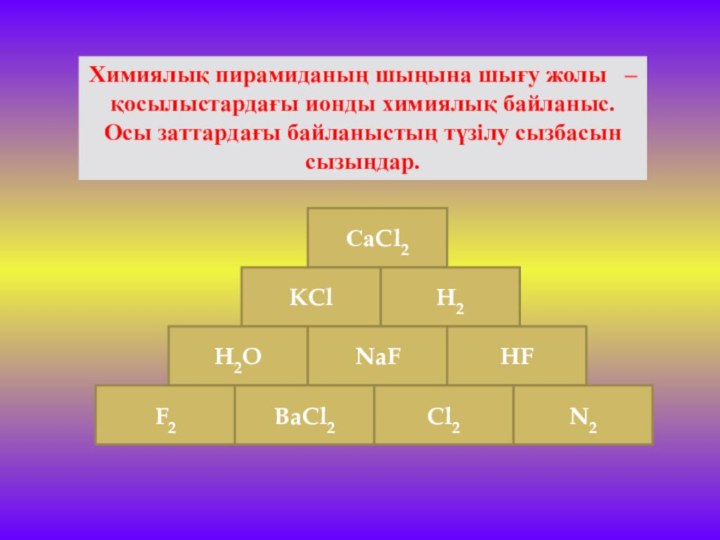
Слайд 19 Химиялық пирамиданың шыңына шығу жолы – қосылыстардағы
ионды химиялық байланыс. Осы заттардағы байланыстың түзілу сызбасын сызыңдар.
Слайд 20 «Крестиктер-ноликтер» ойынын ойнаңдар. Барлығы ионды байланыспен түзілген заттардан
тұратын тік, көлденең немесе қиғаш жолақты табыңдар. Осы заттардағы
ионды байланыстың түзілу жолын сызыңдар.
Слайд 22
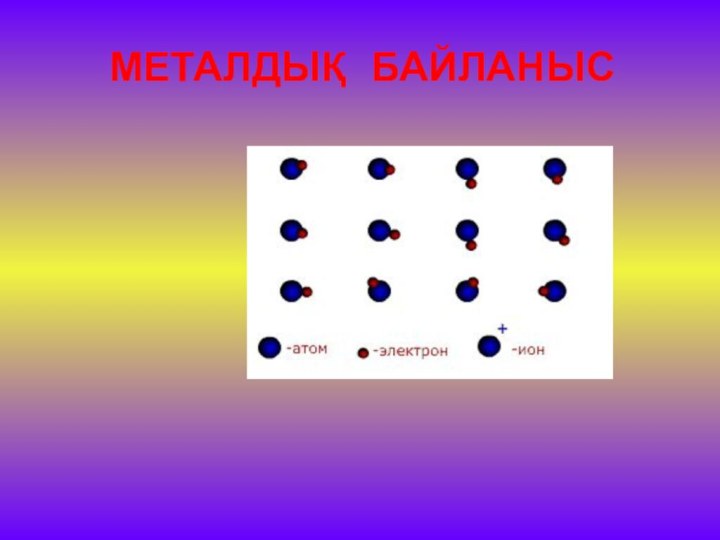
МЕТАЛДЫҚ КРИСТАЛДЫҚ ТОР
Металдар мен олардың балқымалары металдық тор
түрінде кристалданады. Металдық тор түйінінде оң зарядты металл иондары
орналасады. Металл атомдарынан және кристалдық тор түйінінде қалған иондардан алыстаған электрондар катиондар арасында біршама еркін қозғалуға мүмкіндік алады. Осылайша металдардың электр өткізгіштігін қамтамасыз етеді. Иондар мен бос электрондардың арасында электростатикалық әсерлесу пайда болады да, металдық байланыстың түзілуіне себеп болады.
Слайд 23
СУТЕКТІК БАЙЛАНЫСТАР
Сутектік байланыстар – бір молекуладағы сутегі атомдары
мен екінші молекуладағы электртерістілігі күшті элементтер (O, N, F)
арасындағы байланыс.Молекулааралық сутектік байланыстарға мысалдар:
… О - - Н + … О - - Н + …
| |
H + H + вода
… О - - Н + … О - - Н + …
| | +
С2H5 + С2H5 этил спирті
Слайд 24
Байланыстың түзілу механизмі :
Бір молекуланың протоны екінші молекуладағы атомның бөлінбеген электрон жұбына
тартылады.Мысалы :
F, O, N (сирек жағдайда Cl және S) сутекті қосылыстары, спирт. Нәруыздар, нуклеин қышқылдары және басқалар.