- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по теме Скорость химических реакций. Обратимость реакций.
Содержание
- 2. Скорость химических реакций. Обратимость химических реакций.
- 3. Цели урока: Сформировать понятия «Скорость
- 4. План работы.1. Определение понятия «скорость реакции»2. Исследование
- 5. Скорость
- 6. Вспомним Что такое химическая реакция? Какие реакции называются необратимыми и обратимыми? Какие условия необратимости реакции?
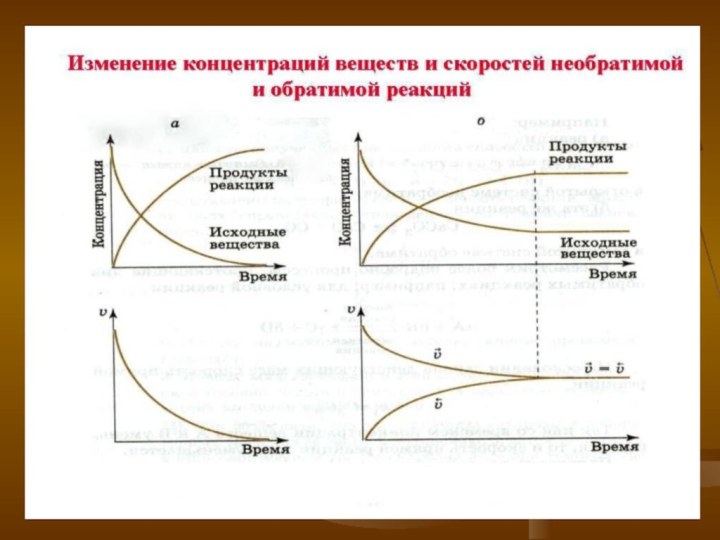
- 7. При протекании химических реакций происходит изменение концентраций
- 9. V= ΔC/ΔtΔC = C2 - C1 (
- 10. Задание 1 группыВ две пробирки налейте растворы
- 11. Задание 2 группыВ две пробирки налейте раствор
- 12. В обе пробирки налейте раствор соляной и
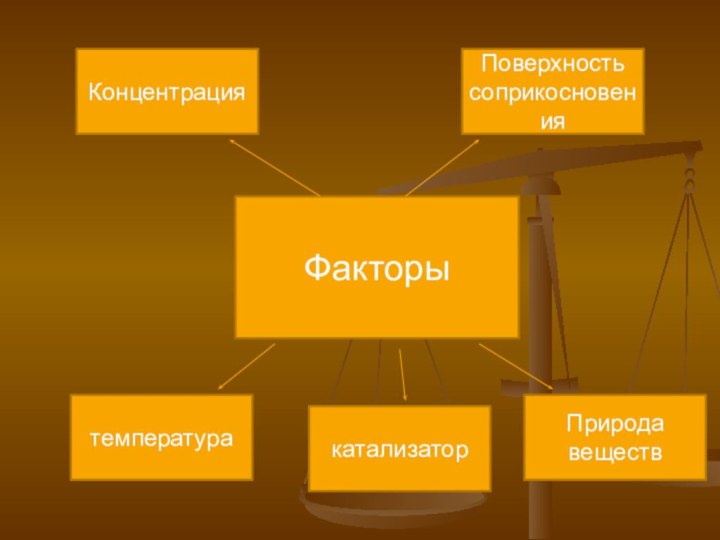
- 13. Факторы температуракатализаторПрирода веществПоверхность соприкосновенияКонцентрация
- 14. 1859—1865 г. русский ученый Бекетов Н.Н. занимался
- 15. Скорость химической реакции прямо пропорциональна произведению концентраций
- 16. V1 = V2k₁ [A]∙[B ] = k2
- 17. Голландский химик Я. Вант-Гофф, в 1901 г.
- 18. Правило Вант-Гоффа: При повышении температуры
- 19. Рассчитать константу равновесия обратимой реакции 2NO +
- 20. Задание 2Как изменится скорость реакции: при повышении
- 21. Химик толкает реакцию в спину:
- 22. Д/з: Задача: для реакции были взяты вещества
- 23. Скачать презентацию
- 24. Похожие презентации












![Презентация по теме Скорость химических реакций. Обратимость реакций. V1 = V2k₁ [A]∙[B ] = k2 [D]∙[Е ]k₁/ k2 = [D]∙[Е](/img/tmb/6/592117/27242cb98753885d05011c8c44343588-720x.jpg)







Слайд 4
План работы.
1. Определение понятия «скорость реакции»
2. Исследование факторов,
влияющих на скорость реакции.
3. Расчет константы равновесия реакции
4. Определение
значения знаний о химическом равновесии
Слайд 6
Вспомним
Что такое химическая реакция?
Какие реакции называются
необратимыми и обратимыми?
Какие условия необратимости реакции?
Слайд 7 При протекании химических реакций происходит изменение концентраций веществ,
участвующих в реакции:
Концентрация реагирующих веществ уменьшается;
Концентрация продуктов увеличивается
А + В D + E
Слайд 9
V= ΔC/Δt
ΔC = C2 - C1 ( молярные
концентрации реагирующих или образующихся веществ)
t = t2 – t1
(момент времени)Единица измерения скорости реакции - моль/ л∙с
Скорость химической реакции - ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени.
Слайд 10
Задание 1 группы
В две пробирки налейте растворы соляной
кислоты (2-3мл) различной концентрации. Для этого в одну из
них налить воды, а затем добавить столько же соляной кислоты. В каждую из пробирок поместите гранулу цинка.- В какой из пробирок реакция началось быстрее?
- Как можно объяснить происходящие явления?
Слайд 11
Задание 2 группы
В две пробирки налейте раствор соляной
кислоты. Одновременно в одну пробирку поместите кусочек, а в
другую - порошок карбоната кальция.- В какой из пробирок реакция пойдет быстрее?
- Как можно объяснить происходящие явления?
Слайд 12 В обе пробирки налейте раствор соляной и поместите
в них по грануле цинка. Одну из пробирок осторожно
нагрейте.- В какой из пробирок выделение газа (какого?) протекает более бурно?
- Как можно объяснить происходящие явления?
Задание 3 группы
Слайд 14 1859—1865 г. русский ученый Бекетов Н.Н. занимался изучением
зависимости скорости реакции от различных факторов. Его исследования имели
большое значение для развития учения о химическом равновесии и для подготовки открытия закона действующих масс.Математическое выражение закона было сформулировано норвежскими учеными К.Гульдбергом и П.Вааге в 1867г.
Слайд 15 Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих
веществ, взятых в степенях равных их стехиометрическим коэффициентам в
уравнении реакции.А + В D + E
Скорость прямой реакции: V1= k₁ [A] [B ]
Скорость обратной реакции: V2= k2 [D] [Е ]
[A] , [B ], [D], [Е ]– концентрации веществ (моль/л),
k₁ и k₂ – коэффициенты
пропорциональности
Закон действующих масс
Слайд 16
V1 = V2
k₁ [A]∙[B ] = k2 [D]∙[Е
]
k₁/ k2 = [D]∙[Е ]/ [A]∙[B ]
К=[D]∙[Е ]/ [A]∙[B
] Какая единица измерения у константы?
Что показывает константа равновесия?
Слайд 17 Голландский химик Я. Вант-Гофф, в 1901 г. стал
первым лауреатом Нобелевской премии по химии.
Она была присуждена
ему за открытие законов химической динамики. Вант-Гофф ввёл представления о пространственном строении химических веществ. Разработав учение о скорости реакций, он создал химическую кинетику.
1852-1911
Слайд 18
Правило Вант-Гоффа:
При повышении температуры на
каждые 10 градусов скорость реакций увеличивается в 2-4 раза
Математическая
формула: V2/ V1 = ΥΔt/10где V2 –скорость реакции при температуре t2,
V1 – скорость реакции при температуре t1,
Υ – температурный коэффициент
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Слайд 19 Рассчитать константу равновесия обратимой реакции 2NO + O2
↔2NO2 . В момент равновесия установились следующие концентрации реагирующих
веществ (моль/л):[ NO ]=0.12; [ O2]=0.6; [ NO2]=0.48.
Задание 1
Решение:
Определяем константу равновесия этой реакции:
K = [ NO2 ] 2 / [ NO ] 2 [ O2 ];
K = (0,48) 2 / (0,12) 2 0,6 = 26.67
Скорость прямой реакции увеличилась в 26,67 раз.
Слайд 20
Задание 2
Как изменится скорость реакции: при повышении температуры
от 10° до 50°С; температурный коэффициент реакции равен 3.
Решение:
V2/
V1 = ΥΔt/10 подставим значения в формулу
V2/ V1 = 3⁵0 -10 /10 = 3⁴=81
Скорость реакции возрастет в 81 раз
Слайд 21 Химик толкает реакцию в спину:
«Давай-ка тебя я немного подвину!» Она отвечает: «Ты знаешь меня: Ни часа, ни дня не могу без огня!
И химик подумал: «Теперь мне все ясно.
Тепло поглощаешь – и это прекрасно! Как только под колбой зажгутся горелки, Ступай-ка, реакция, прямо по стрелке.
Побольше я выдам тебе вещества». Реакция стала работать послушно,
Продукт образуя полезный и нужный.
Такой вот привиделся химику сон.
Какие же выводы сделает он ?





























