периоде
F – сила притяжения
внешнего электрона
к ядру своего атома
R1 >
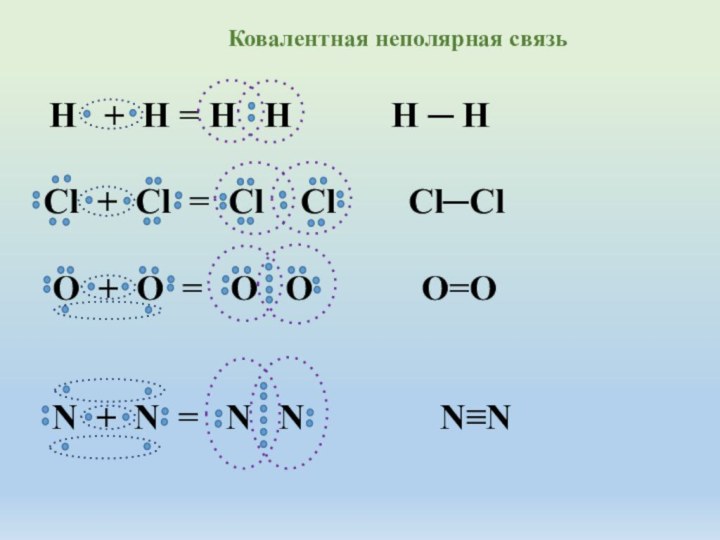
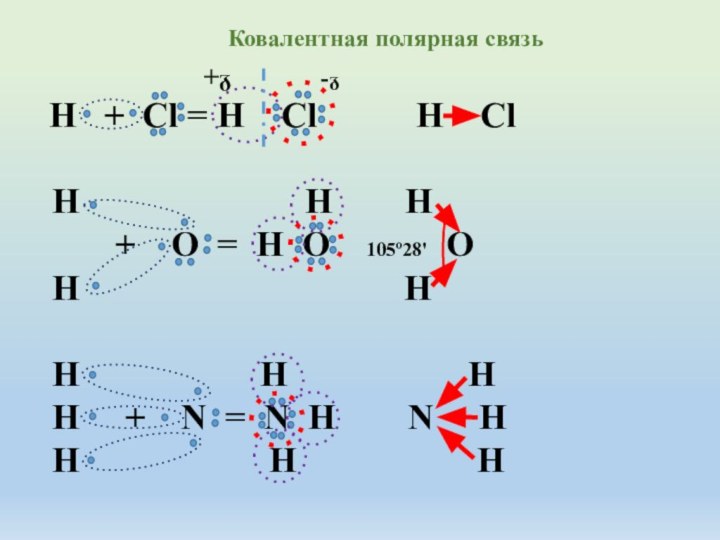
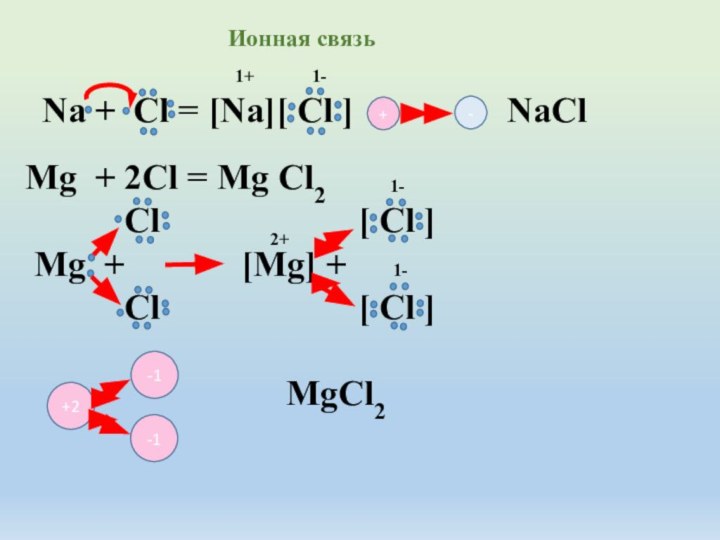
R2 > R3 > R4 > R5 > R6 > R7 > R8 радиус атома от первой группы к восьмой уменьшается, так как увеличивается сила притяжения электрических зарядов отрицательно заряженных электронов и положительно заряженных ядер атомов. С переходом по таблице Д.И.Менделеева от первой группы к следующей заряд ядра каждого атома увеличивается и увеличивается заряд электронов и по закону Кулона сила притяжения разноименных зарядов увеличивается . Следовательно наибольшей силой притяжения электронов даже от других атомов обладает атом седьмой группы главной подгруппы, во втором периоде, да и во всей таблице - атом фтора F.Способность атомов химического элемента оттягивать к себе электронные пары , участвующие в образовании химической связи от других атомов называется электроотрицательностью. Таким свойство обладают атомы только неметаллов.
Ряд электроотрицательности неметаллов.
H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F
Свойства атомов в периоде Периодической системы химических
элементов Д.И. Менделеева
F1 < F2 < F3 < F4 < F5 < F6 < F7 < F8