Слайд 2
Содержание
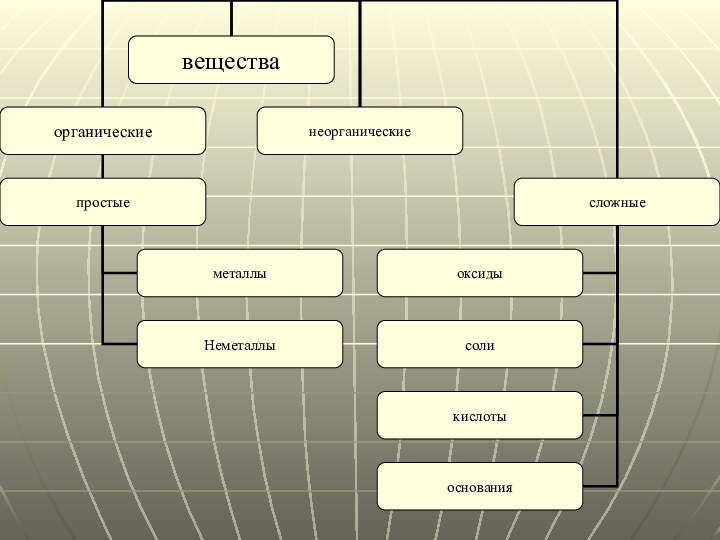
Вещества
Неорганические соединения
Классификация неорганических соединений
Простые вещества
Металлы
Неметаллы
Аллотропия
Агрегатное состояние
Сложные
вещества
Оксиды и их химические свойства
Кислоты и их химические
свойства
Основания и их химические свойства
Соли и их химические свойства
Слайд 4
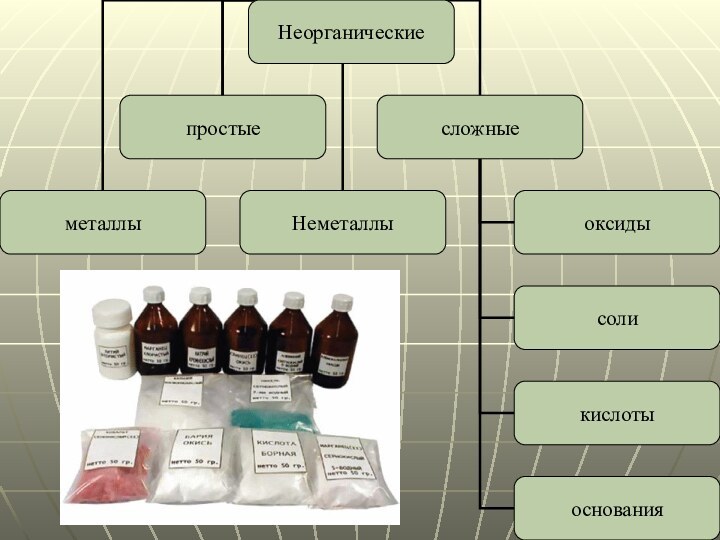
Неорганические вещества
Неорганическое вещество или неорганическое соединение — это
химическое вещество, химическое соединение, которое не является органическим, то
есть они не содержат углерода. Неорганические соединения не имеют характерного для органических углеродного скелета.
Делиться:
По количеству элементов
По составу
По химическим свойствам
Слайд 6
Простые вещества
Простые вещества — вещества, состоящие исключительно из
атомов одного химического элемента.
Они делятся на неметаллы
и металлы
Известно свыше 400 разновидностей простых веществ
Слайд 7
Металлы
Мета́лл (название происходит от лат. metallum —
шахта) — группа элементов, обладающая характерными металлическими свойствами, такими
как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и др.
Из 117 химических элементов, открытых на данный момент, к металлам относят:
6 элементов в группе щелочных металлов,
4 в группе щелочноземельных металлов,
38 в группе переходных металлов,
11 в группе лёгких металлов,
7 в группе полуметаллов,
14 в группе лантаноиды + лантан,
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний
Слайд 8
Неметаллы
Немета́ллы — химические элементы с типично неметаллическими
свойствами, которые занимают правый верхний угол Периодической системы
Характерной особенностью
неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Слайд 9
Аллотропные модификации
Явление аллотропии может быть обусловлено либо различным
составом молекул данного элемента, либо различным строением молекул и
способом размещения молекул (атомов) в кристаллах. Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности
Слайд 10
Агрегатное состояние
При нормальных условиях, соответствующие простые вещества 11-ти
элементов являются газами (H, He, N, O, F, Ne,
Cl, Ar, Kr, Xe, Rn), 2х — жидкостями (Br, Hg), остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Ртуть (−39 °C)
Франций (27 °C)
Цезий (28 °C)
Галлий (30 °C)
Рубидий (39 °C)
Слайд 11
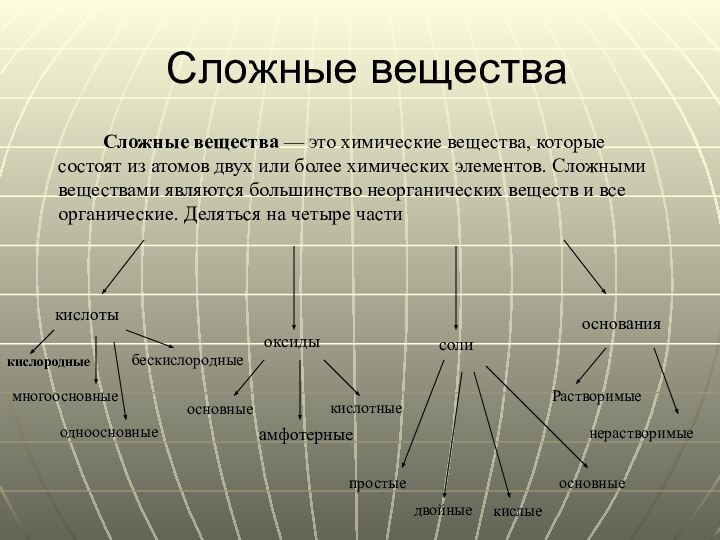
Сложные вещества
Сложные вещества — это химические вещества, которые
состоят из атомов двух или более химических элементов. Сложными
веществами являются большинство неорганических веществ и все органические. Деляться на четыре части
кислоты
оксиды
соли
основания
многоосновные
одноосновные
кислородные
бескислородные
основные
амфотерные
кислотные
простые
двойные
кислые
основные
Растворимые
нерастворимые
Слайд 12
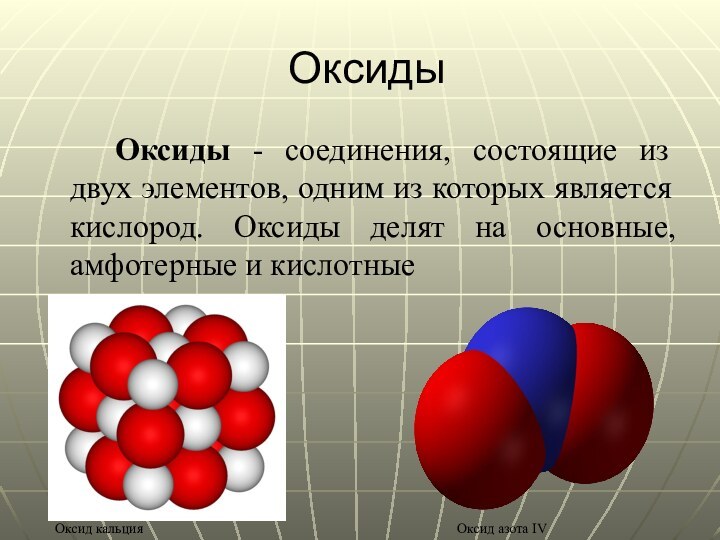
Оксиды
Оксиды - соединения, состоящие из двух элементов,
одним из которых является кислород. Оксиды делят на основные,
амфотерные и кислотные
Оксид кальция
Оксид азота IV
Слайд 13
Химические свойства
Основные оксиды
1. Основный оксид + кислота =

соль + вода
CuO + H2SO4 = CuSO4 + H2O
2.
Сильноосновный оксид + вода = щелочь
CaO + H2O = Ca(OH)2
3. Сильноосновный оксид + кислотный оксид = соль
CaO + Mn2O7 = Ca(MnO4)2
Na2O + CO2 = Na2CO3
4. Основный оксид + водород = металл + вода
CuO + H2 = Cu + H2O
Кислотные оксиды
1. Кислотный оксид + вода = кислота
SO3 + H2O = H2SO4
2. Кислотный оксид + основный оксид = соль
CO2 + CaO = CaCO3
3. Кислотный оксид + основание = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
4. Нелетучий оксид + соль1 = соль2 + летучий оксид
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
ZnO + 2HCl = ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
ZnO + 2KOH + H2O = K2[Zn(OH)4)] (в водном растворе)
ZnO + CaO = CaZnO2 (при сплавлении)
Слайд 14
Кислоты
Кислота — это электролит, отдающий электрон в
реакции с основанием, то есть веществом, принимающим электрон.
Кислоты
бывают одноосновные, многоосновные, бескислородный, кислородные
Серная кислота
Угольная кислота
Слайд 15
Химические свойства
Взаимодействие с оксидами металлов
Взаимодействие с амфотерными
оксидами
Взаимодействие с щелочами
Взаимодействие с нерастворимыми основаниями
Взаимодействие с солями
Слайд 16
Основания
Основания — вещества, молекулы которых состоят из ионов
металлов или иона аммония и одной (или нескольких) гидроксогруппы
-OH.
Бывают растворимые
и не растворимые
Гидроксид натрия
Слайд 17
Химические свойства
Действие на индикаторы: лакмус - синий, метилоранж
- жёлтый, фенолфталеин - малиновый,
2. Основание + кислота =
Соли + вода Примечание:реакция не идёт, если и кислота, и щёлочь слабые.
NaOH + HCl = NaCl + H2O
3. Щёлочь + кислотный или амфотерный оксид = соли + вода
2NaOH + SiO2 = Na2SiO3 + H2O
4. Щёлочь + соли = (новое)основание + (новая) соль прим-е:исходные вещества должны быть в растворе, а хотя бы 1 из продуктов реакции выпасть в осадок или мало растворяться. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH
5.Слабые основания при нагреве разлагаются: Cu(OH)2+Q=CuO + H2O
6.При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид:
AgNO3 + 2NaOH(p) → NaNO3+Ag2O+H2O
Слайд 18
Соли
Соли — вещества, состоящие из катионов металла
и анионов кислотного остатка. Бывают простые, двойные, кислотные и
основные
Кристаллы морской соли