- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Свойства серной кислоты 9 класс
Содержание
- 2. Строение солекулыСе́рная кислота́ H2SSO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6)
- 3. Немного историиВпервые серная кислота, была получена итальянским
- 4. Физические свойства
- 6. ХарактеристикаСерная кислота обладает сильными свойствами и считается
- 7. Особые свойства концентрированной серной кислотыКонцентрированная серная
- 8. Симптомы, первая помощь и лечение отравления
- 9. 2SO2+O2 = 2SO3На третьем, последнем этапе, получают
- 10. Промышленное производство серной кислоты (контактный способ)1)
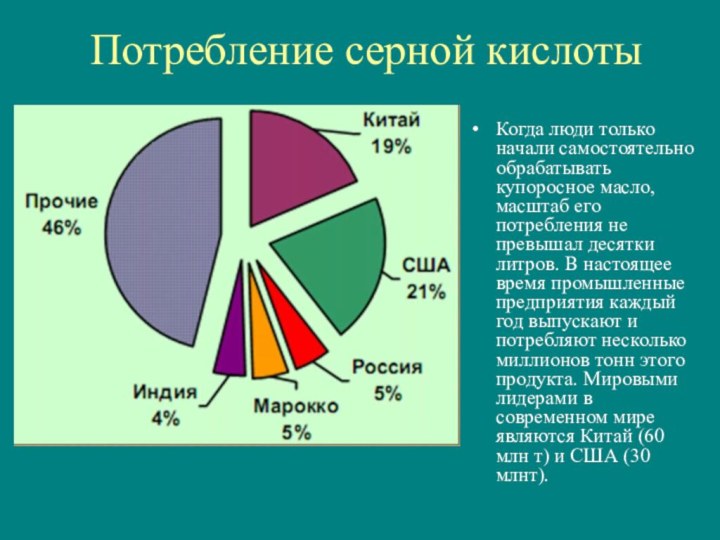
- 11. Потребление серной кислотыКогда люди только начали самостоятельно
- 12. Применение серной кислоты
- 13. Скачать презентацию
- 14. Похожие презентации
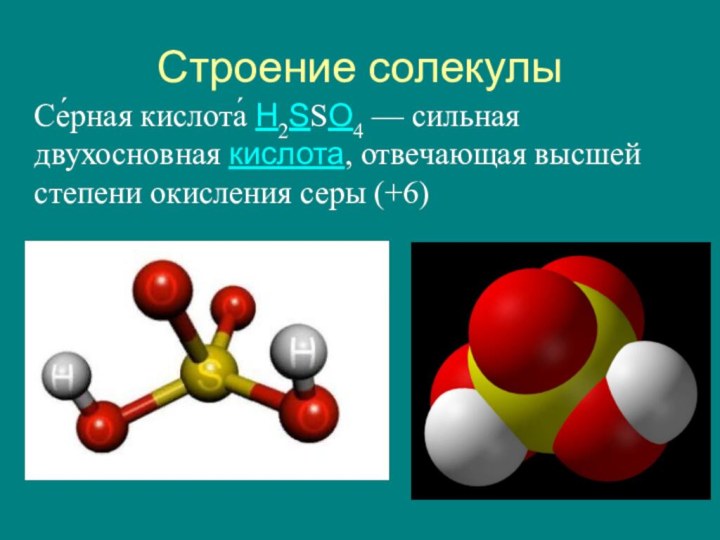
Строение солекулыСе́рная кислота́ H2SSO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6)











Слайд 2
Строение солекулы
Се́рная кислота́ H2SSO4 — сильная двухосновная кислота, отвечающая высшей степени
окисления серы (+6)
Слайд 3
Немного истории
Впервые серная кислота, была получена итальянским ученым
В. Бирингуччо в 1540 г. и немецким алхимиком Василием
Валентином в конце XVI – начале XVII вв.В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом», очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
Слайд 6
Характеристика
Серная кислота обладает сильными свойствами и считается мощным
окислителем. Поскольку на один моль SO3 приходится один моль
Н2О, её принято относить к моногидратам. Она образовывает кислые (бисульфаты) и средние (сульфаты) соли. Для усиления действия и преобразования кислоты в двухосновную, в результате чего она получит два атома водорода, потребуется взаимодействие с водным раствором. А при реакции с простой водой в больших объёмах начнёт выделяться тепло.
Слайд 7
Особые свойства
концентрированной серной кислоты
Концентрированная серная кислота является
сильным окислителем; при взаимодействии с металлами (кроме Au, Pt)
восстанавливаться до S+4O2, S0 или H2S-2 в зависимости от активности металла. Без нагревания не реагирует с Fe, Al, Cr – пассивация. При взаимодействии с металлами, обладающими переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты: Fe0 → Fe3+, Cr0 → Cr3+, Mn0 → Mn4+,Sn0 → Sn4+Слайд 8 Симптомы, первая помощь и лечение отравления парами серной
кислоты
Серная кислота – промышленный реагент, контакт с которым представляет
реальную угрозу для жизни и здоровья человека. Причём в форме пара это соединение не менее ядовито, чем в своей классической (жидкой) форме. Ситуацию осложняет полное отсутствие у этого реагента запаха и цвета. Это делает серную кислоту одной из самых опасных химических субстанций, которую мы вынуждены использовать в различных сферах своей деятельности – начиная от промышленности и заканчивая бытом
Слайд 9
2SO2+O2 = 2SO3
На третьем, последнем этапе, получают олеум,
для этого серный ангидрид растворяют в концентрированной серной кислоте:
H2SO4+nSO3 ↔ H2SO4·nSO3
В дальнейшем олеум транспортируется в железных цистернах, а серная кислота получается из олеума разбавлением водой:
Серную кислоту в промышленности получают двумя способами: контактным и нитрозным.
Контактный способ получения H2SO4:
На первом этапе получают сернистый газ путем обжига серного колчедана:
4FeS2+11O2 = 2Fe2O3+8SO2↑
На втором этапе, сернистый газ окисляют кислородом воздуха до серного ангидрида, реакция идет в присутствии оксида ванадия, играющего роль катализатора:
H2SO4·nSO3+H2O → H2SO4
Получение серной кислоты
Слайд 10
Промышленное производство серной
кислоты (контактный способ)
1)
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2)
2SO2 + O2 V2O5→ 2SO33) nSO3 + H2SO4 → H2SO4·nSO3 (олеум)
Измельчённый очищенный влажный пирит (серный колчедан) сверху засыпают в печь для обжига в «кипящем слое«. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом.





























