плохо растворим в воде, легко соединяется с кислородом
воздуха, образуя бурый газ.II вариант
Бесцветный газ с характерным резким запахом, хорошо растворим в воде, легче воздуха.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть











II вариант
Бесцветный газ с характерным резким запахом, хорошо растворим в воде, легче воздуха.
II вариант
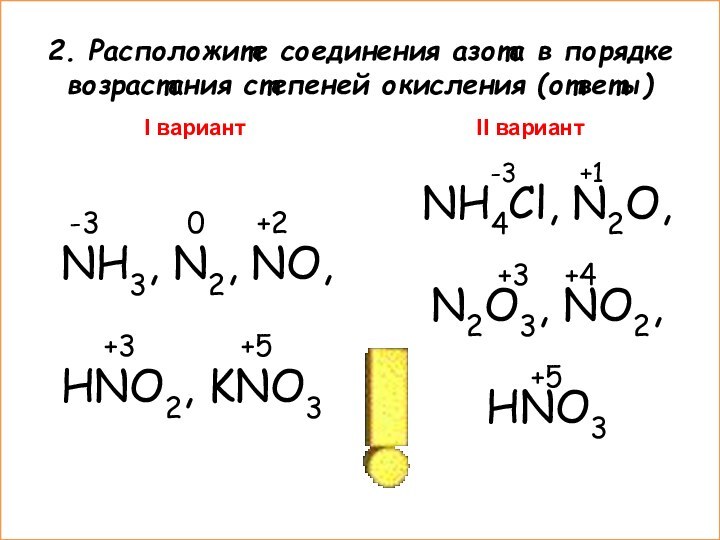
-3 +1
NH4Cl, N2O,
+3 +4
N2O3, NO2,
+5
HNO3
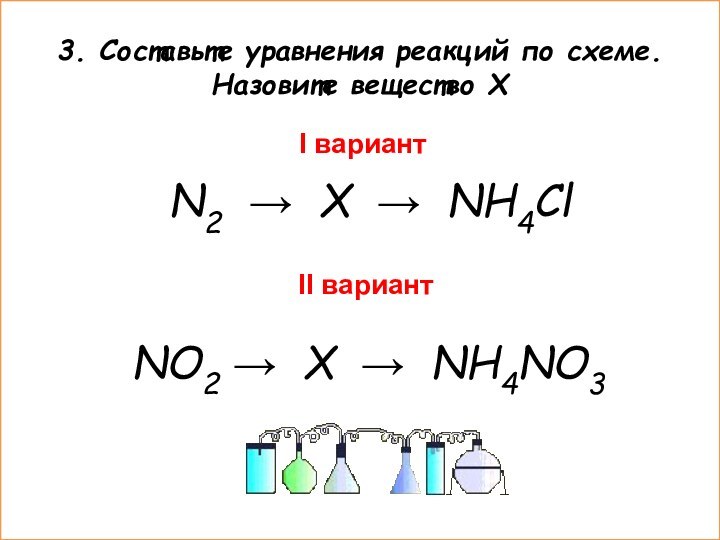
II вариант
X – HNO3 (азотная кислота)
1.4NO2+2H2O+O2=4HNO3
2. HNO3 + NH3=NH4NO3