- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Гидролиз
Содержание
- 2. Содержание урока1. Понятие :гидролизКлассификация гидролиза2. Гидролиз органических веществ3. Гидролиз солей4. Гидролиз неорганических веществ
- 3. Гидролиз – это реакция обменного разложения веществ
- 4. Классификация гидролиза
- 5. гидролиз
- 6. Гидролиз органических веществГидролиз галагеналкановГидролиз сложных эфиров (жиров)Гидролиз углеводовГидролиз белковГидролиз АТФ (аденозинтрифосфорная кислота)
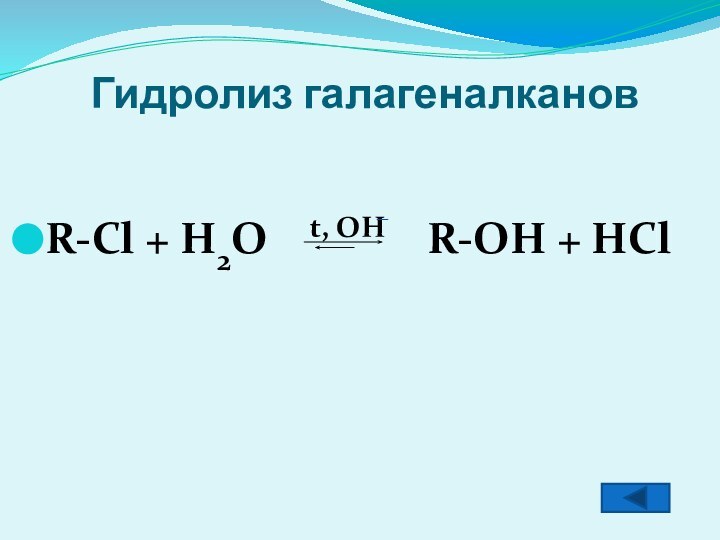
- 7. Гидролиз галагеналкановR-Cl + H2O t, OH R-OH + HCl
- 8. Гидролиз сложных эфиров (жиров)
- 9. Гидролиз углеводовКрахмал пищиГлюкозаCO2 , H2O,
- 10. Гидролиз белков
- 11. Гидролиз АТФ (аденозинтрифосфорная кислота)АТФ + Н2О Н3РО4 + АДФ + энергия
- 12. Гидролиз солейСущность гидролиза сводится к обменному химическому
- 13. Классификация солей
- 14. Слабые кислоты:HCOOH, CH3COOH, HCN, H2S, HF,H2CO3, H2
- 15. KNO2 = K+ +
- 16. Гидролиз солей, образованных слабым основанием и сильной
- 17. Гидролиз солей, образованных слабым основанием и слабой
- 18. Гидролиз солей, образованных сильным основанием и сильной
- 19. Гидролиз солей
- 20. Гидролиз неорганических соединений Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения:карбиды;галогениды;фосфиды;нитриды
- 21. Гидролиз карбидов CaC2 + 2H2O = Ca(OH)2
- 22. Скачать презентацию
- 23. Похожие презентации
Содержание урока1. Понятие :гидролизКлассификация гидролиза2. Гидролиз органических веществ3. Гидролиз солей4. Гидролиз неорганических веществ












Слайд 2
Содержание урока
1. Понятие :
гидролиз
Классификация гидролиза
2. Гидролиз органических веществ
3.
Гидролиз солей
Слайд 3
Гидролиз – это реакция обменного разложения веществ водой
Частицы
растворенного вещества в воде окружены гидратной оболочкой. В некоторых
случаях это приводит к химическому взаимодействию с образованием новых веществ, к реакции гидролизаhydro – вода, lysis - распад
Слайд 6
Гидролиз органических веществ
Гидролиз галагеналканов
Гидролиз сложных эфиров (жиров)
Гидролиз углеводов
Гидролиз
белков
Гидролиз АТФ (аденозинтрифосфорная кислота)
Слайд 8
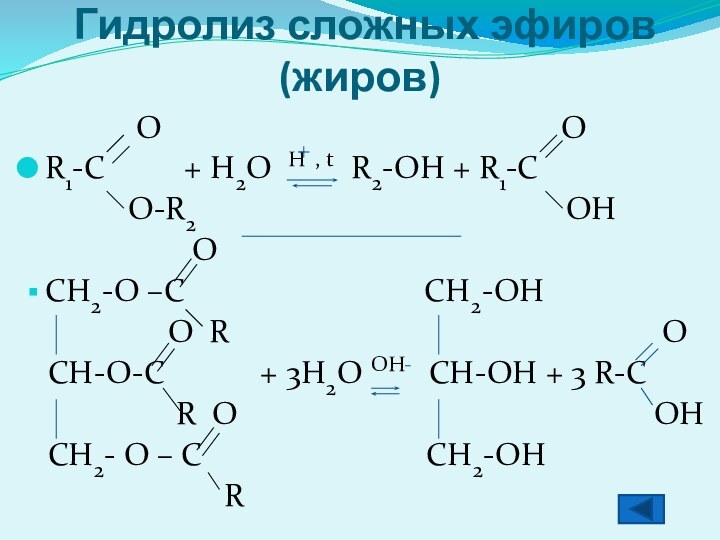
Гидролиз сложных эфиров (жиров)
O
OR1-C + H2O H , t R2-OH + R1-C
O-R2 OH
O
CH2-O –C CH2-OH
O R O
CH-O-C + 3H2O OH CH-OH + 3 R-C
R O OH
CH2- O – C CH2-OH
R
Слайд 9
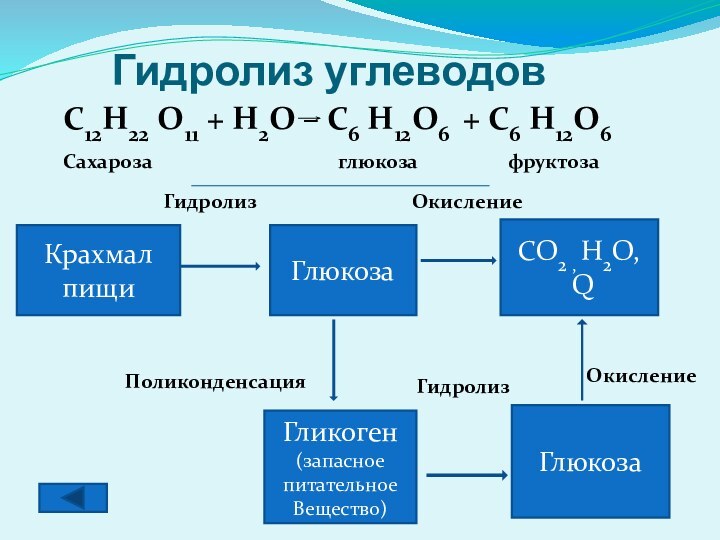
Гидролиз углеводов
Крахмал пищи
Глюкоза
CO2 , H2O,
Q
Гликоген
(запасное
питательное
Вещество)
Глюкоза
Гидролиз
Окисление
Поликонденсация
Гидролиз
Окисление
C12H22
O11 + H2O – C6 H12O6 + C6 H12O6
Сахароза
глюкоза фруктоза
Слайд 10
Гидролиз белков
O H
O HH2N – CH2 – C – N – CH – C – N – CH – COOH
CH2 CH2
OH OH трипептид
HO H HO H
O O O
H2N – CH2 – C + H2N – CH – C + H2N – CH – C
OH OH OH
CH2 CH2
OH SH
аминокислоты
Слайд 12
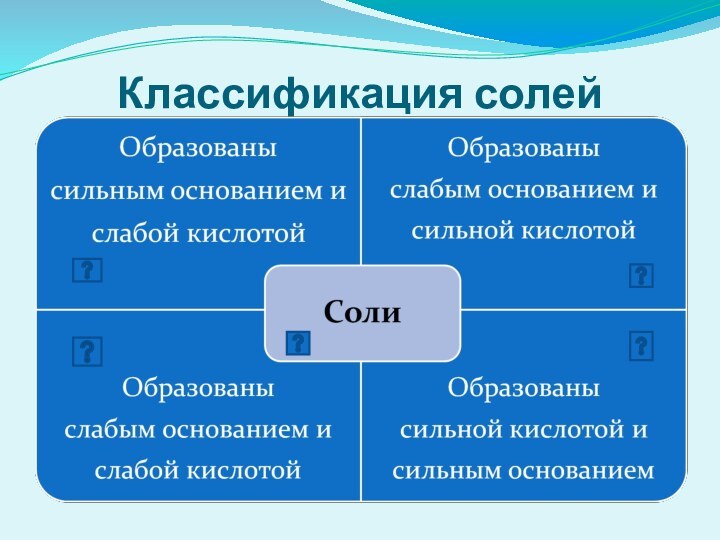
Гидролиз солей
Сущность гидролиза сводится к обменному химическому взаимодействию
катионов или анионов соли с молекулами воды. В результате
образуется слабый электролит.Любая соль – это продукт взаимодействия основания с кислотой. В зависимости от силы основания и кислоты выделяют 4 типа солей.
Слайд 14
Слабые кислоты:
HCOOH, CH3COOH, HCN, H2S, HF,
H2CO3, H2 SO3,
H3PO4 , HNO2 ;
Слабые основания:
основания (за исключением щелочей), NH4
OH
Слайд 15
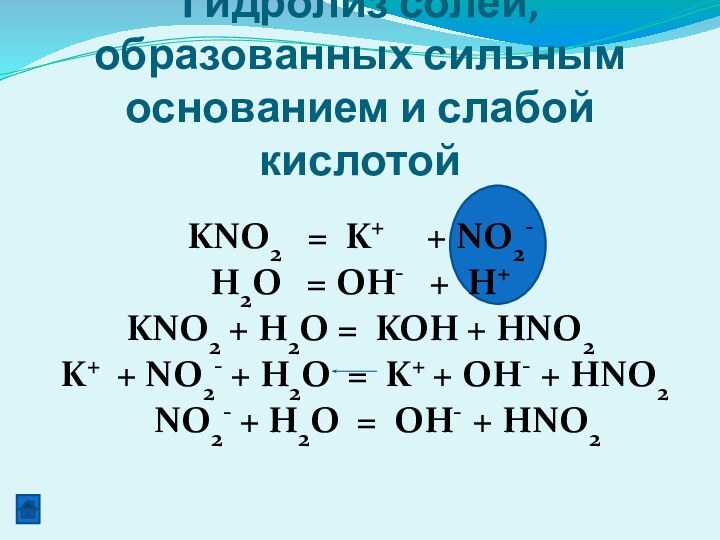
KNO2 = K+ + NO2-
H2O = OH- + H+
KNO2 + H2O
= KOH + HNO2K+ + NO2- + H2O = K+ + OH- + HNO2
NO2- + H2O = OH- + HNO2
Гидролиз солей, образованных сильным основанием и слабой кислотой
Слайд 16
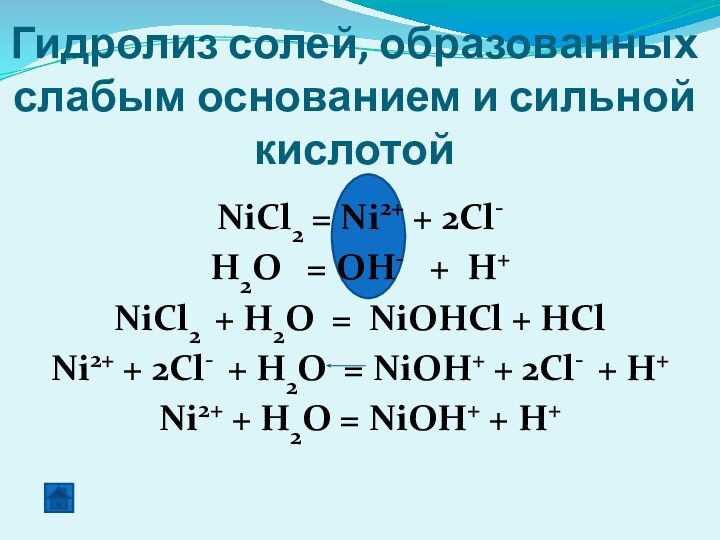
Гидролиз солей, образованных слабым основанием и сильной кислотой
NiCl2 = Ni2+ + 2Cl-
H2O = OH-
+ H+NiCl2 + H2O = NiOHCl + HCl
Ni2+ + 2Cl- + H2O = NiOH+ + 2Cl- + H+
Ni2+ + H2O = NiOH+ + H+
Слайд 17
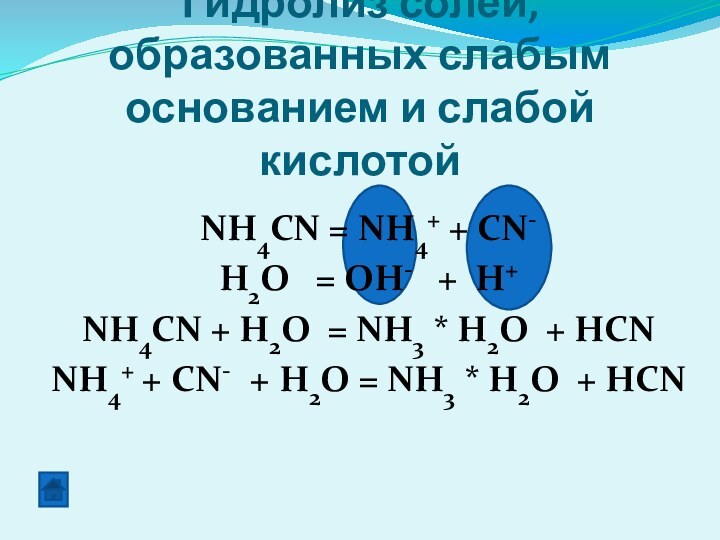
Гидролиз солей, образованных слабым основанием и слабой кислотой
NH4CN = NH4+ + CN-
H2O = OH-
+ H+NH4CN + H2O = NH3 * H2O + HCN
NH4+ + CN- + H2O = NH3 * H2O + HCN
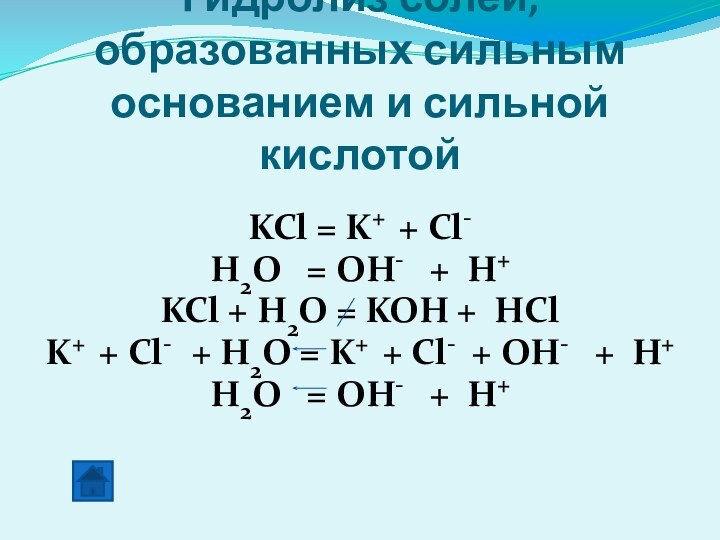
Слайд 18 Гидролиз солей, образованных сильным основанием и сильной кислотой
KCl = K+ + Cl-
H2O = OH-
+ H+KCl + H2O = KOH + HCl
K+ + Cl- + H2O = K+ + Cl- + OH- + H+
H2O = OH- + H+
Слайд 20
Гидролиз неорганических соединений
Полному и необратимому
гидролизу в водном растворе подвергаются некоторые бинарные соединения:
карбиды;
галогениды;
фосфиды;
нитриды
Слайд 21
Гидролиз карбидов
CaC2 + 2H2O = Ca(OH)2 +C2
H2
Карбид кальция
ацетиленAl4C3 + 12 H2O = 4 Al(OH)3 + 3 CH4
Карбид алюминия метан