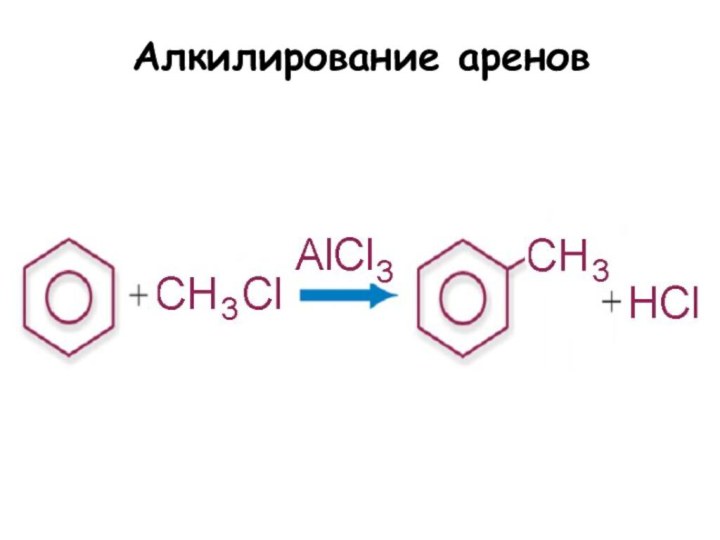
Слайд 3
ПЛАН.
ОпределениеОпределение. Определение. Общая формула класса углеводородовОпределение. Общая формула
класса углеводородов.
Гомологический рядГомологический ряд.
Виды изомерииВиды изомерии.
Номенклатура алканов
СтроениеСтроение Строение алкановСтроение
алканов.
Физические свойстваФизические свойства.
Способы полученияСпособы получения.
Химические свойстваХимические свойства.
ПрименениеПрименение.
Слайд 4
АЛКАНЫ. (ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ.
ПАРАФИНЫ. НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ.)
Алканы - углеводороды
в молекулах которых все атомы углерода связаны одинарными связями
(σ-) и имеют общую формулу:
CnH2n+2
Слайд 5
ГОМОЛОГИЧЕСКИЙ РЯД МЕТАНА
СН4 метан
С2H6 этан
C3H8
пропан
C4H10 бутан
C5H12 пентан
C6H14 гексан
C7H16 гептан
C8H18 октан
C9H20 нонан
C10H22 декан
Гомологи – это вещества, сходные по строению и свойствам
и отличающиеся на одну или более групп СH2.
Слайд 6
ИЗОМЕРИЯ АЛКАНОВ
Структурная изомерия:
CH3 - CH2 - CH2
- CH2 - CH3
или
CH3 – CH - CH2 -
CH3
│
CH3
Слайд 7
НОМЕНКЛАТУРА АЛКАНОВ
Алгоритм.
Выбор главной цепи:
CH3 – CH - CH2
- CH3
│
CH3
Слайд 8
НОМЕНКЛАТУРА АЛКАНОВ
2. Нумерация атомов главной цепи:
1 2 3 4
CH3 – CH - CH2 - CH3
│
CH3
Слайд 9
НОМЕНКЛАТУРА АЛКАНОВ
3. Формирование названия:
1 2
3 4
CH3 – CH - CH2 - CH3
│
CH3
2 - метилбутан
Слайд 10
РАДИКАЛ – ЭТО ЧАСТИЦА, ИМЕЮЩАЯ НЕСПАРЕННЫЕ ЭЛЕКТРОНЫ.
Слайд 11
ЗАДАНИЕ. Дайте названия следующим углеводородам по международной номенклатуре.
СН3
СН3 – СН2 – С – СН3
СН3
2,2 - диметилбутан
СН3 – СН – СН – СН – СН3
СН3 С2Н5 СН3
2,4 – диметил - 3 – этилпентан
Слайд 12
СТРОЕНИЕ МЕТАНА
Длина С-С – связи = 0,154
нм
Слайд 13
СТРОЕНИЕ МЕТАНА
Строение метана ссылка
Слайд 14
Это означает, что все четыре
гибридные орбитали атома углерода одинаковы по форме, энергии и
направлены в углы равносторонней треугольной пирамиды -тетраэдра. Углы между орбиталями равны 109°28.
Все связи в молекулах алканов одинарные. Перекрывание происходит по оси соединяющей ядра атомов, т.е. это σ-связи.
В молекулах алканов все атомы углерода находятся в состоянии sp³-гибридизации.
В молекуле этана (CH3–СH3) одна из семи σ- связей (С–С) образуется в результате перекрывания двух sp3- гибридных орбиталей атомов углерода. Длина С–С связи в алканах равна 0,154нм(1,54*10ˉ¹ºм). Связи С–Н несколько короче.
Слайд 16
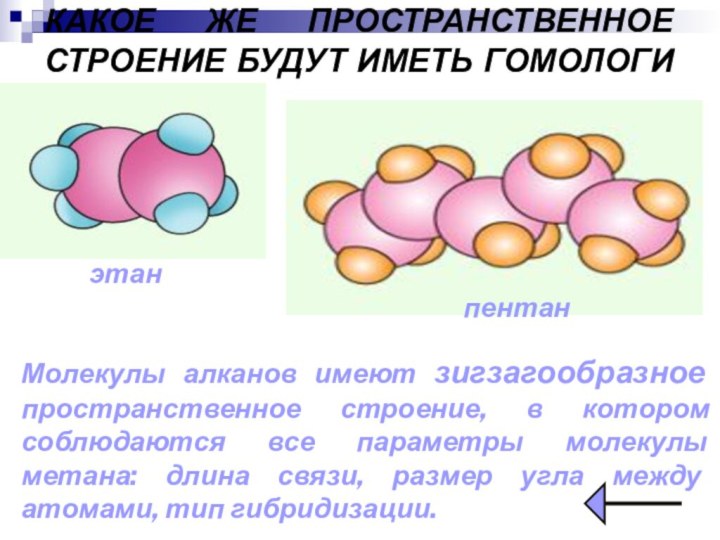
КАКОЕ ЖЕ ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ БУДУТ ИМЕТЬ ГОМОЛОГИ МЕТАНА?
этан
пентан
Молекулы
алканов имеют зигзагообразное пространственное строение, в котором соблюдаются все
параметры молекулы метана: длина связи, размер угла между атомами, тип гибридизации.
Слайд 17
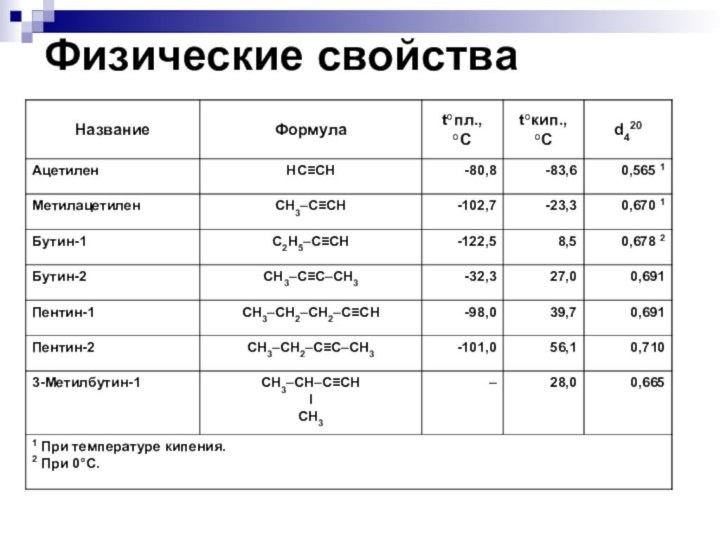
ФИЗИЧЕСКИЕ СВОЙСТВА
С увеличением относительных молекулярных масс предельных
углеводородов закономерно повышаются их температуры кипения и плавления.
СН4…C4Н10
– газы
T кипения:
-161,6…-0,5 °C
T плавления:
-182,5…-138,3 °C
С16Н34…и далее– твёрдые вещества
T кипения:
287,5 °C
T плавления:
20 °C
С5Н12…C15Н32 – жидкости
T кипения:
36,1…270,5 °C
T плавления:
-129,8…10 °C
Слайд 18
Получение алканов
1 –выделение углеводородов из природного сырья
2-
гидрирование циклоалканов и непредельных углеводородов
3- декарбоксилирование натриевых солей карбоновых
кислот
4- синтез Вюрца
5- гидролиз карбидов
Слайд 19
Реакции гидрирования
Циклоалканов:
С5Н10 + Н2 = С5Н12
2Алкинов:
С2Н2 + 2Н2
= С2Н6
Алкенов:
С2Н4 + Н2 = С2Н6
Алкадиенов:
С4Н6 + 2Н2 =
С4 Н10
+ Н2
Слайд 20
Получение метана при сплавлении ацетата натрия со щелочью:
t °C
CH3COONa + NaOH ⎯⎯→ CH4 ⇑ + Na2CO3
ацетат натрия метан
Свойства метана:1) метан не вступает в реакцию окисления при действии водного раствора KMnO4;
2) метан не вступает в реакцию с раствором брома;
3) горение метана:
CH4 + 2О2 ⎯⎯→ СО2 + 2Н2О + Q
Получение алканов
Слайд 21
Синтез Вюрца
проводят с целью получения алканов с более
длинной углеродной цепью.
Например: получение этана из метана
1 этап.
Галогенирование исходного алкана
СН4 + Сl2 = CH3Cl + HCl
2 этап. Взаимодействие с натрием
2CH3Cl + 2Na = C2H6 + 2NaCl
Слайд 22
Метан в лаборатории можно получить гидролизом карбида алюминия
Al4C3
+ 12H2O = 4Al(OH)3 + 3CH4
Слайд 24
СН4 + Сl2 CH3Cl +
HCl + Q
t
Реакции протекают по радикальному механизму.
С
Н
Н
Н
Н
+ НО NO2
СН3
NO2
+ H2O + Q
С Н
Н
Н
Н
+ НО SO3H
СН3
SO3H
+ H2O + Q
t
t
ХИМИЧЕСКИЕ СВОЙСТВА:
1. РЕАКЦИЯ ЗАМЕЩЕНИЯ.
2) Реакция нитрования (Коновалова):
1) Реакция галогенирования:
3) Реакция сульфирования:
Слайд 25
2. Реакции изомеризации:
СН3
СН2 СН2 СН2
СН3
t, катализатор
СН3 СН СН2 СН3
СН3
3.Реакции с водяным паром:
СН4 + Н2О СО + 3Н2
800°С
синтез-газ
4. Реакции дегидрирования:
2СН4 Н С ≡ С Н + 3Н2 + Q
1500°С
СН3 СН3 Н2С=СН2 + Н2 + Q
5.Реакции окисления:
Предельные углеводороды горят (пламя не коптящее)
С3Н8 + 5О2
3СО2 + 4Н2О + Q
В присутствии катализаторов окисляются:
СН4 + О2
500°С, катализатор
Н С
О
Н
+ Н2О + Q
2СН3(СН2)34СН3 + 5О2
4СН3 (СН2)16СООН +2Н2О + Q
Слайд 26
6. РЕАКЦИЯ ГОРЕНИЯ:
CH4 + 2O2 → CO2 +
2H2O + Q
Слайд 27
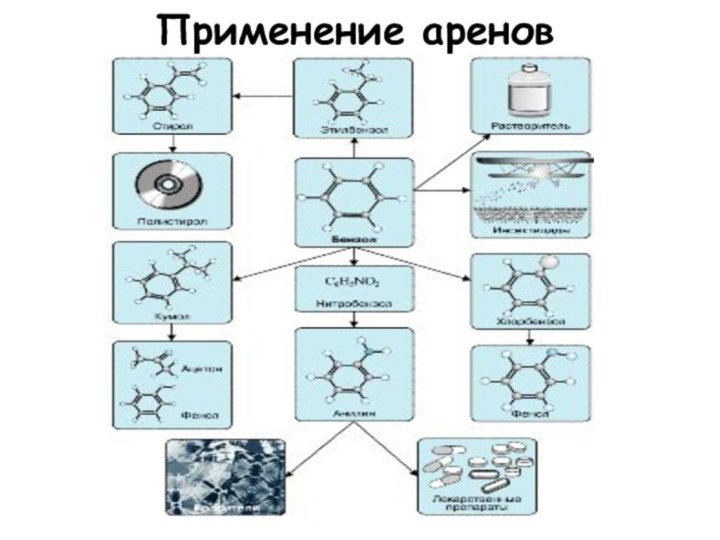
Применение
Получение ацетилена
Горючее для дизельных и турбореактивных двигателей
Получение
растворителей
В металлургии
А также сырьё для синтезов спиртов, альдегидов, кислот.
Слайд 28
ПРИМЕНЕНИЕ АЛКАНОВ
1-3 – производство сажи
(1 – картриджи;
2
– резина;
3 – типографическая краска)
4-7 – получение
органических веществ
(4
– растворителей;
5 – хладогентов,
используемых
в холодильных установках;
6 – метанол;
7 - ацетилен)
Слайд 29
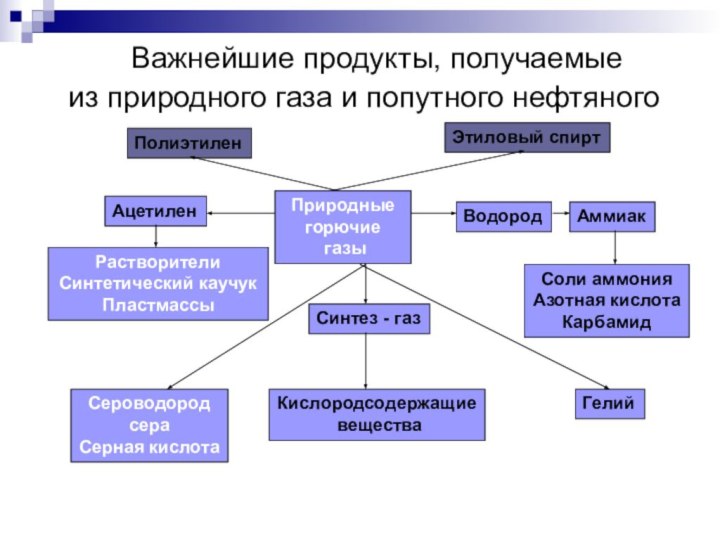
Важнейшие продукты, получаемые
из природного газа
и попутного нефтяного газа
Природные
горючие
газы
Ацетилен
Водород
Аммиак
Соли аммония
Азотная кислота
Карбамид
Растворители
Синтетический каучук
Пластмассы
Сероводород
сера
Серная кислота
Синтез - газ
Кислородсодержащие
вещества
Гелий
Полиэтилен
Этиловый спирт
Слайд 30
Проверка знаний
Какие углеводороды относят к алканам?
Запишите формулы
возможных изомеров гексана и назовите их по систематической номенклатуре.
Напишите
формулы возможных продуктов крекинга октана
4. В каком объёмном соотношении смесь метана с воздухом становится взрывоопасной?
5. Каковы природные источники получения алканов?
6. Назовите области применения алканов
Слайд 31
ДОМАШНЕЕ ЗАДАНИЕ
Учебник О.С. Габриелян
(10 класс базовый уровень)
§
3, упр. 4, 7, 8 (стр. 32)
Слайд 32
Задача
Дано:
Ι вариант
ΙΙ вариант
Дано:
Найти:
Формулу углеводорода
Найти:
DО2= 2,25
Формулу углеводорода
Решение
DH2= 71
Мч(СnН2n+2) = 71 * 2
= 142
12n+2n+2 = 142
14n= 140
n = 10 C10H22
Мч(СnН2n+2) = 2,25* 32 = 72
12n+2n+2 = 72
14n= 70
n = 5 C5H12
СnН2n+2
СnН2n+2
Слайд 33
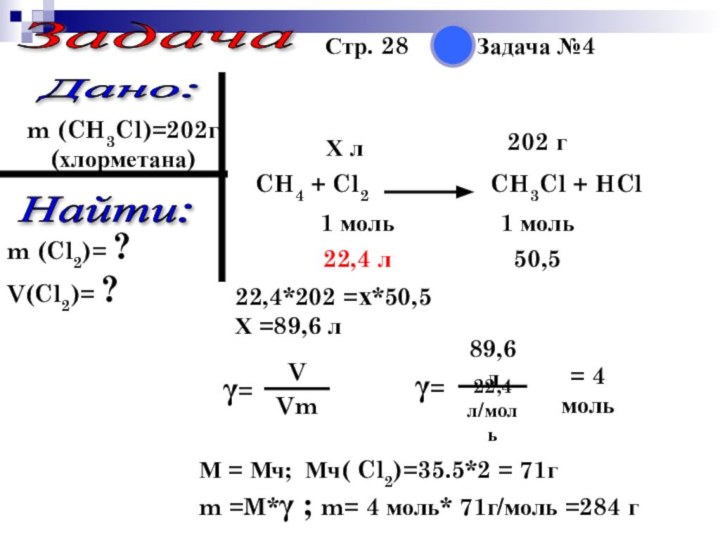
Задача
Стр. 28 Задача
№4
Дано:
m (CH3Cl)=202г
(хлорметана)
Найти:
m (Cl2)=
?
V(Cl2)= ?
CH4 + Cl2 CH3Cl + HCl
202 г
1 моль
Х л
1 моль
50,5
22,4 л
22,4*202 =х*50,5
Х =89,6 л
М = Мч; Мч( Cl2)=35.5*2 = 71г
m =M*γ ; m= 4 моль* 71г/моль =284 г
Слайд 34
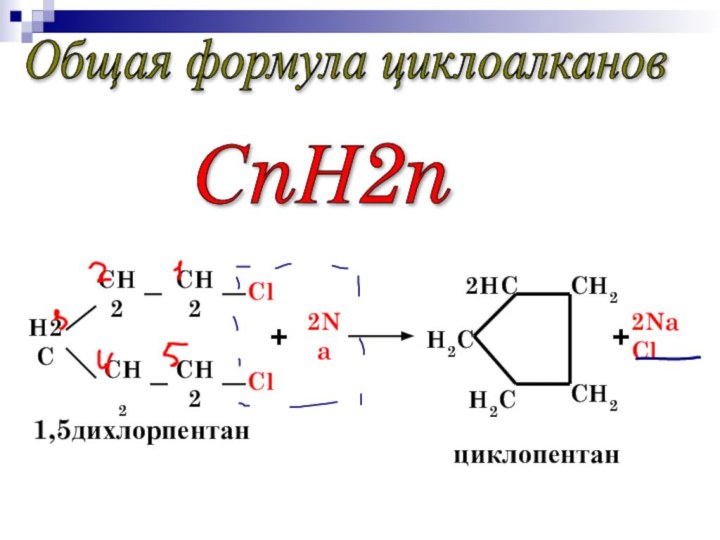
Общая формула циклоалканов
СnН2n
Слайд 35
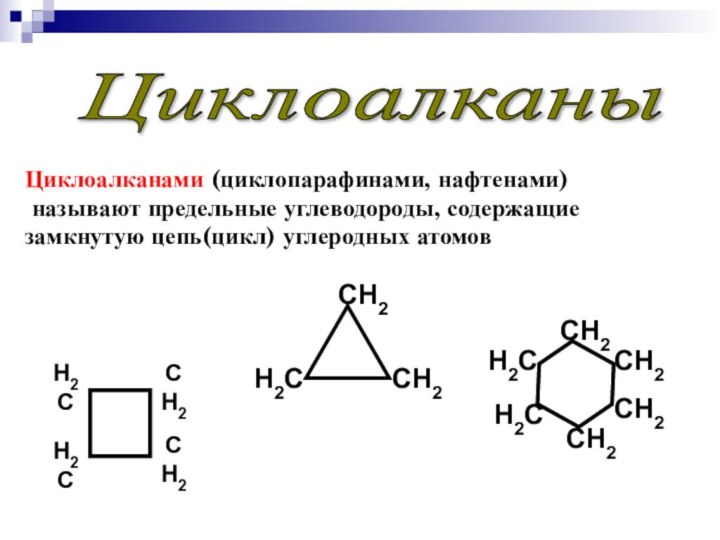
Циклоалканы
Циклоалканами (циклопарафинами, нафтенами)
называют предельные углеводороды, содержащие
замкнутую цепь(цикл) углеродных атомов
Слайд 36
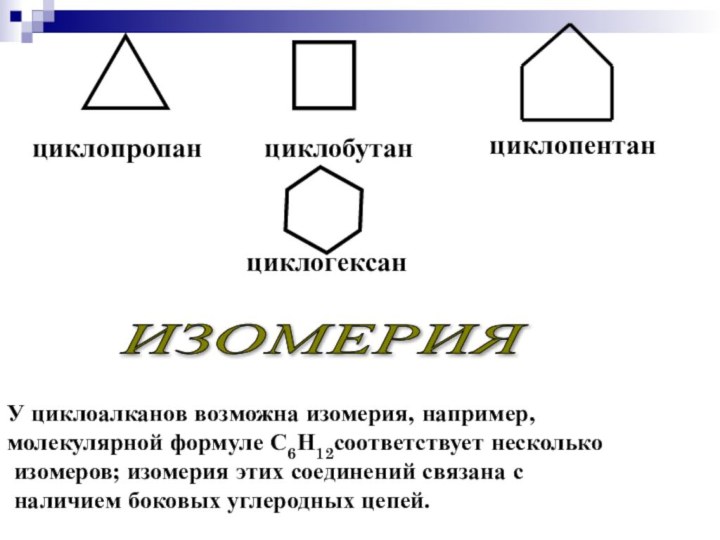
циклопропан
циклобутан
циклопентан
циклогексан
Слайд 37
циклопропан
циклобутан
циклопентан
циклогексан
У циклоалканов возможна изомерия, например,
молекулярной формуле С6Н12соответствует
несколько
изомеров; изомерия этих соединений связана с
наличием боковых
углеродных цепей.
ИЗОМЕРИЯ
Слайд 38
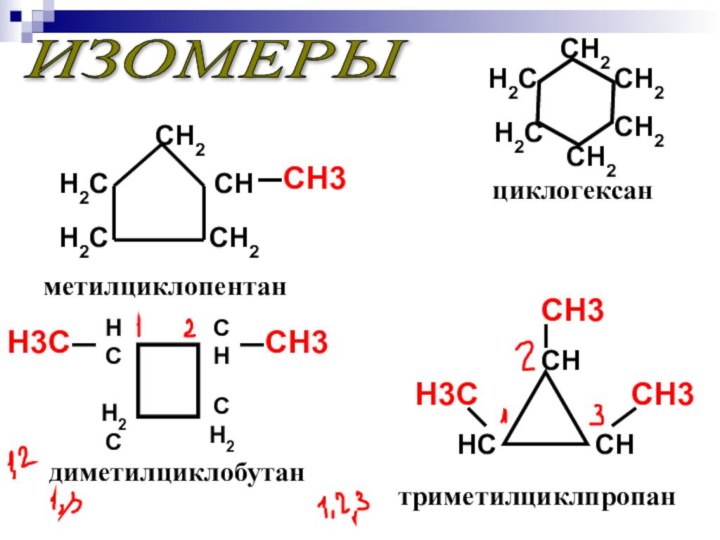
ИЗОМЕРЫ
циклогексан
метилциклопентан
триметилциклпропан
диметилциклобутан
Слайд 40
Нахождение в природе
Циклоалканы главным образом находятся в
составе
некоторых нефтей. Отсюда и другое название
циклоалканов – нафтены.
Пяти – и шестичленные
циклоалканы были впервые выделены их нефти и
изучены профессором Московского университета
В.В. Марковниковым
Слайд 41
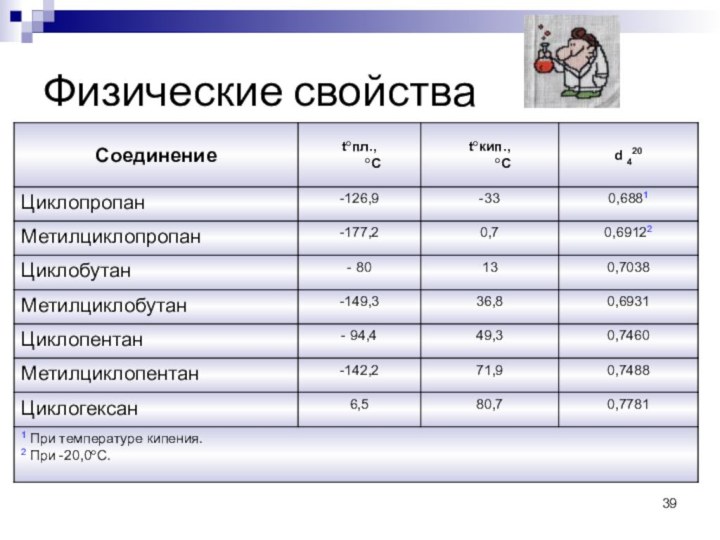
Циклоалканы в воде практически не растворяются.
Физические свойства
Циклопропан
и циклобутан –газы при н.у.
С5 – С10 –
жидкости,
Последующие – твердые вещества.
Слайд 42
Общая формула циклоалканов
СnН2n
1,5дихлорпентан
циклопентан
Слайд 43
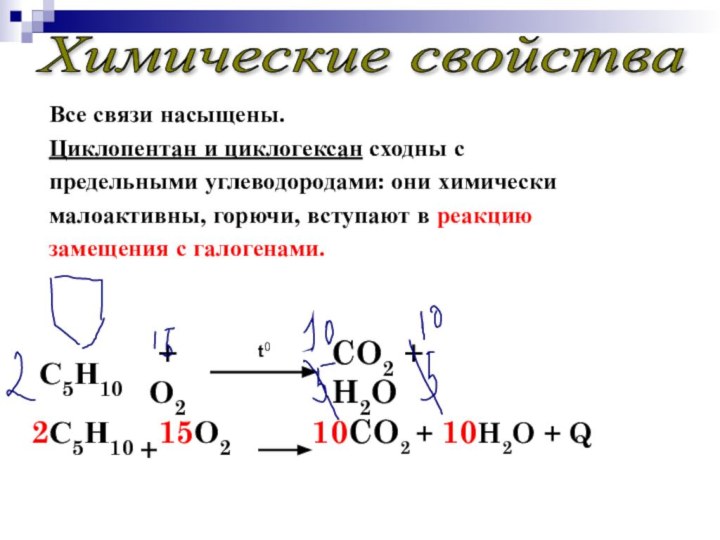
Все связи насыщены.
Циклопентан и циклогексан сходны с
предельными
углеводородами: они химически
малоактивны, горючи, вступают в реакцию
замещения с галогенами.
Химические
свойства
CO2 + H2O
2С5Н10 +15О2 10CO2 + 10H2O + Q
Слайд 44
Химические свойства.
Для малых циклов(С=3,4) характерны реакции присоединения с
разрывом цикла, для больших циклов (С>5)- реакции замещения
С3Н6+Br2--- C3H6Br2
C5H10+
Br2---C5H9Br +HBr
Слайд 45
Химические свойства
Реакции замещения
+ HCl
Слайд 46
Химические свойства
По химическому характеру малые циклы
(циклопропан и
циклобутан) склоны к
реакциям присоединения, в результате которых
происходит разрыв цикла
и образуются алканы
и их производные.
а)присоединение брома
1,3дибромпропан
Слайд 47
а)гидрирование( присоединение водорода)
циклопропан
пропан
Слайд 48
Реакции дегидрирования
циклогексан
Слайд 49
Применение
Практическое значение имеют циклогексан,
метилциклогексан, и некоторые
другие. В
процессе ароматизации нефти эти соединения
превращаются в
ароматические углеводороды –
бензол, толуол и другие вещества. Которые широко
используются для синтеза красителей,
медикаментов и т. д. Циклопропан применяют для
Наркоза.
Слайд 50
Применение
Наибольшее практическое значение имеют циклогексан, этилциклогексан.
Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама,
а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
Слайд 51
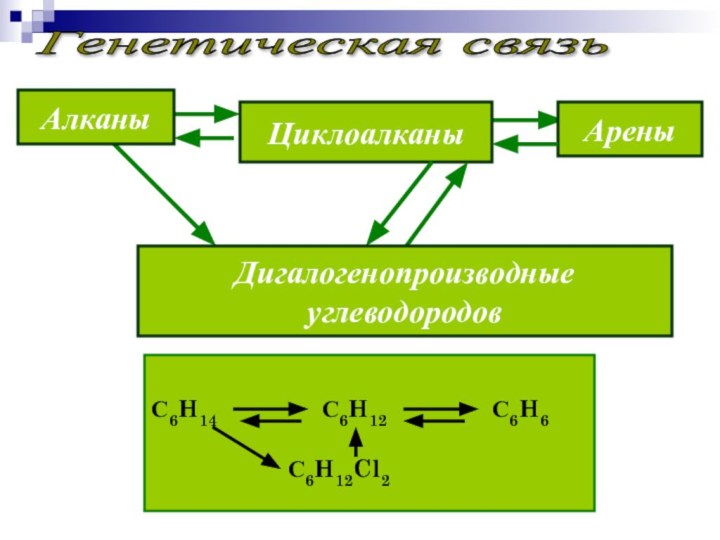
Генетическая связь
Циклоалканы
Арены
Алканы
Дигалогенопроизводные
углеводородов
Слайд 52
§8, упр.4
Подготовиться к практической работе:
Стр.32, Пр. №
1
Повторить качественную реакцию на оксид углерода (ΙV) –CO2
Домашняя работа
Слайд 53
Алкены
Непредельные углеводороды ряда этилена.
Слайд 54
Основное содержание
Понятие о непредельных углеводородах.
Характеристика двойной связи.
Изомерия
и номенклатура алкенов.
Получение алкенов.
Свойства алкенов.
Слайд 55
Понятие об алкенах
Алкены – углеводороды, содержащие в молекуле
одну двойную связь между атомами углерода, а качественный и
количественный состав выражается общей формулой СnН2n, где n ≥ 2.
Алкены относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
Слайд 56
Характеристика двойной связи
(С ═ С)
Вид гибридизации –
Валентный
угол –
Длина связи С = С –
Строение
─
Вид связи –
По типу перекрывания –
Слайд 57
Схема образования
sp2-гибридных орбиталей
В гибридизации участвуют орбитали одного
s- и двух p-электронов:
s
2p
sp2
Слайд 59
Гомологический ряд алкенов
Этен
Пропен
Бутен
Пентен
Гексен
C2H4
C3H6
C4H8
C5H10
C6H12
Общая
формула СnН2n
Слайд 60
Изомерия алкенов
Для алкенов возможны два типа изомерии:
1-ый тип
– структурная изомерия:
углеродного скелета
положения кратной связи
межклассовая
2-ой тип –
пространственная изомерия:
геометрическая
Слайд 61
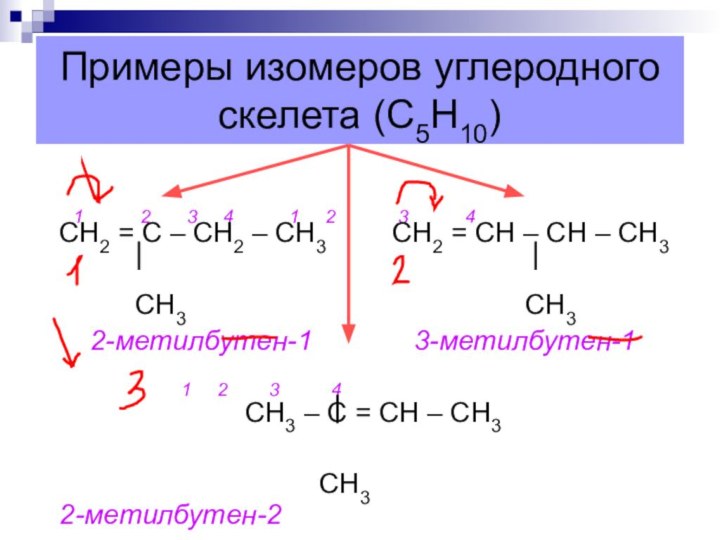
Примеры изомеров углеродного скелета (С5Н10)
1
2 3 4 1 2
3 4 СН2 = С – СН2 – СН3 СН2 = СН – СН – СН3
СН3 СН3
2-метилбутен-1 3-метилбутен-1
1 2 3 4
СН3 – С = СН – СН3
СН3 2-метилбутен-2
Слайд 62
Примеры изомеров положения двойной связи ( С5Н10)
1
2 3 4 5 СН2 = СН – СН2 – СН2 – СН3
пентен-1
1 2 3 4 5
СН3 – СН = СН – СН2 – СН3
пентен-2
Слайд 63
Межклассовая изомерия
АЛКЕНЫ ЯВЛЯЮТСЯ МЕЖКЛАССОВЫМИ
ИЗОМЕРАМИ ЦИКЛОАЛКАНОВ.
Н2С – СН2 СН
– СН3
Н2С – СН2 Н2С СН2
Циклобутан Метилциклопропан
СН2 = СН – СН2 – СН3 - бутен-1
Циклобутан и метилциклопропан являются изомерами бутена, т. к. отвечают общей формуле С4Н8 .
С4Н8
Слайд 64
Примеры межклассовых изомеров
( С5Н10)
СН2 = СН –
СН2 – СН2 – СН3
пентен -1
циклопентан
Слайд 65
Пространственная изомерия (С4Н8)
Для алкенов возможна пространственная изомерия, поскольку
вращение относительно двойной связи, в отличии от одинарной невозможно.
1 4 1
Н
2 3 2 3
С = С С = С
4
Н Н Н Цис-бутен-2 Транс-бутен-2
Н3С
СН3
Н3С
СН3
Слайд 66
ЦИС - ИЗОМЕРЫ
СН3
СН3
\ /
-----С=С--------
/ \
Н Н
Слайд 67
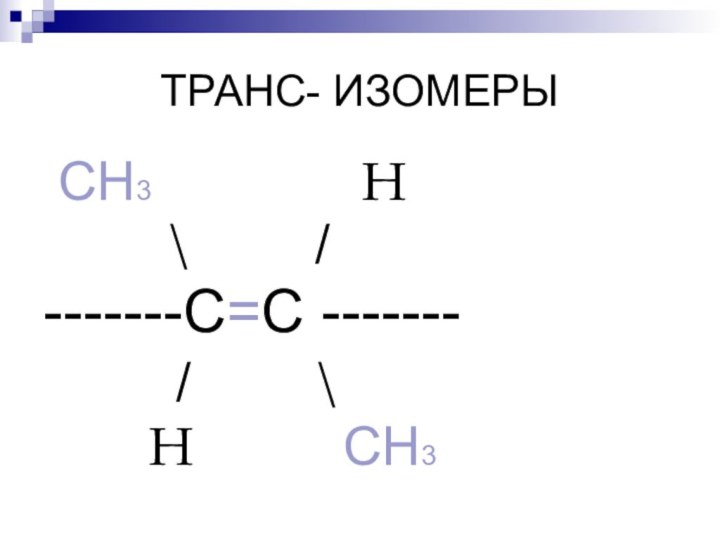
ТРАНС- ИЗОМЕРЫ
СН3
Н
\ /
-------С=С -------
/ \
Н СН3
Слайд 68
Геометрические изомеры бутена
Цис-изомер
Транс-изомер
Слайд 69
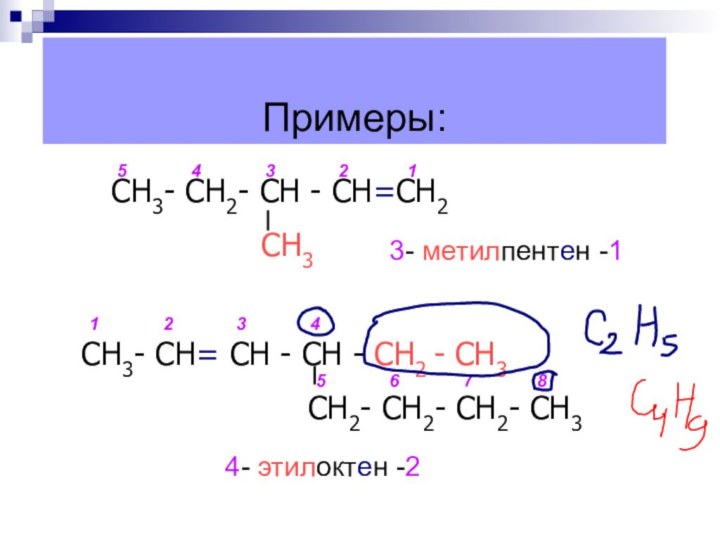
Примеры:
4- этилоктен -2
СН3- СН2- СН -
СН=СН2
СН3
СН3- СН= СН - СН - СН2 - СН3
СН2- СН2- СН2- СН3
1
2
3
4
5
6
7
8
1
2
3
4
5
3- метилпентен -1
Слайд 70
Физические свойства алкенов
Алкены плохо растворимы в воде, но
хорошо растворяются в органических растворителях.
С2– С4 - газы
С5–
С16 - жидкости
С17… - твёрдые вещества
С увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.
Слайд 71
Химические свойства алкенов
По химическим свойствам алкены резко отличаются
от алканов. Алкены более химически активные вещества, что обусловлено
наличием двойной связи, состоящей из σ- и π-связей. Алкены способны присоединять два одновалентных атома или радикала за счёт разрыва π-связи, как менее прочной.
Слайд 72
Типы химических реакций, которые характерны для алкенов
Реакции присоединения.
Реакции
полимеризации.
Реакции окисления.
Слайд 73
Механизм реакций присоединения алкенов
π-связь является донором электронов, поэтому
она легко реагирует с электрофильными реагентами.
Электрофильное присоединение: разрыв π-связи
протекает по гетеролитическому механизму, если атакующая частица является электрофилом.
Свободно-радикальное присоединение: разрыв связи протекает по гомолитическому механизму, если атакующая частица является радикалом.
Слайд 74
Реакции присоединения
1. Гидрирование.
CН2 = СН2 + Н2 СН3
– СН3
Этен этан
Условия реакции: катализатор – Ni, Pt, Pd
2. Галогенирование.
1 2 3
CН2 = СН – СН3 + Сl – Сl СН2 – СН – СН3
пропен
Cl Cl
1,2-дихлорпропан
Реакция идёт при обычных условиях.
Слайд 75
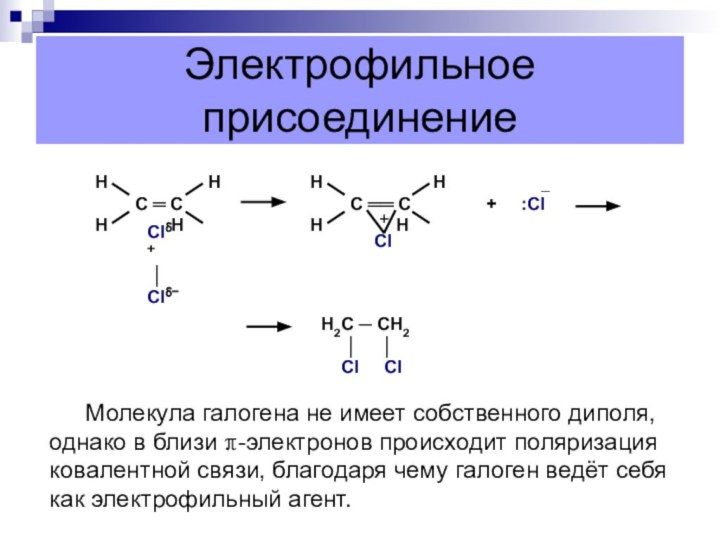
Электрофильное присоединение
Молекула галогена не имеет собственного диполя,
однако
в близи π-электронов происходит поляризация
ковалентной связи, благодаря чему галоген
ведёт себя
как электрофильный агент.
Слайд 76
Реакции присоединения
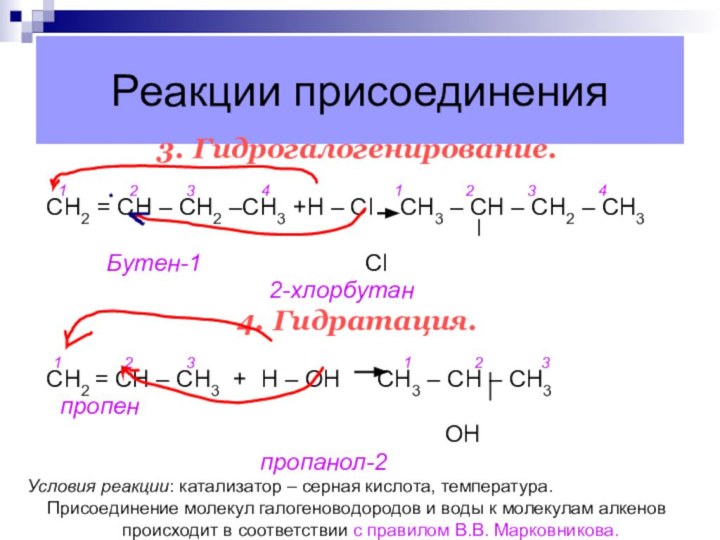
3. Гидрогалогенирование.
1
2
3 4 1 2 3 4
СН2 = СН – СН2 –СН3 +Н – Сl CН3 – СН – СН2 – СН3
Бутен-1 Cl
2-хлорбутан
4. Гидратация.
1 2 3 1 2 3
CН2 = СН – СН3 + Н – ОН СН3 – СН – СН3
пропен
ОН
пропанол-2
Условия реакции: катализатор – серная кислота, температура.
Присоединение молекул галогеноводородов и воды к молекулам алкенов происходит в соответствии с правилом В.В. Марковникова.
Слайд 77
Гидрогалогенирование гомологов этилена
Правило В.В. Марковникова
Атом водорода присоединяется к
наиболее гидрированному атому углерода при двойной связи, а атом
галогена или гидроксогруппа – к наименее гидрированному.
Слайд 78
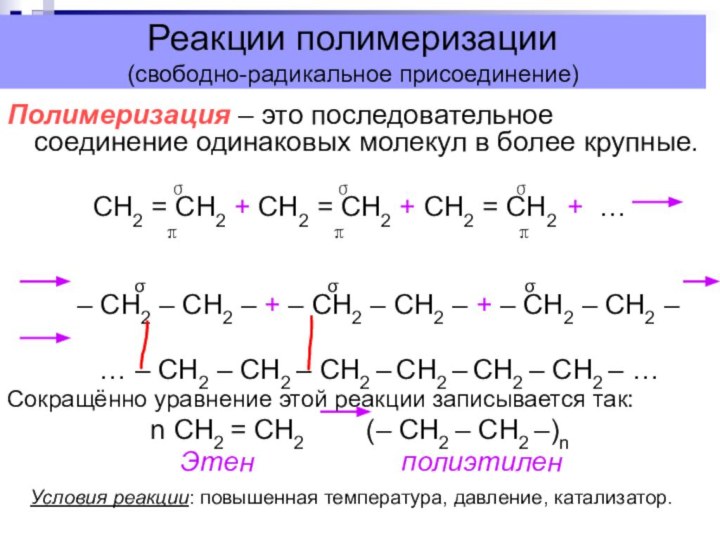
Реакции полимеризации
(свободно-радикальное присоединение)
Полимеризация – это последовательное соединение одинаковых
молекул в более крупные.
σ σ σ
СН2 = СН2 + СН2 = СН2 + СН2 = СН2 + …
π π π
σ σ σ
– СН2 – СН2 – + – СН2 – СН2 – + – СН2 – СН2 –
… – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – …
Сокращённо уравнение этой реакции записывается так:
n СН2 = СН2 (– СН2 – СН2 –)n
Этен полиэтилен
Условия реакции: повышенная температура, давление, катализатор.
Слайд 79
Возможные продукты окисления алкенов
эпоксиды
диолы
альдегиды
или кетоны
кислоты
Слайд 80
Реакции окисления
Реакция Вагнера. (Мягкое окисление раствором перманганата калия).
3СН2
= СН2 +2КМnО4 +4Н2О 3СН2 - СН2 +2МnО2+2КОН
ОН ОН
Или (О)
С2Н4 + Н2О С2Н4(ОН)2
этандиол
этен
Слайд 81
Реакции окисления
3. Каталитическое окисление.
а) 2СН2 = СН2 +
О2 2СН3 – CОН
этен уксусный альдегид
Условия реакции: катализатор – влажная смесь двух солей PdCl2 и CuCl2.
б) 2СН2 = СН2 + О2 2СН2 СН2
этен
О
оксид этилена
Условия реакции: катализатор – Ag, t = 150-350ºС
Слайд 82
Горение алкенов
Алкены горят красноватым светящимся пламенем, в
то время как пламя предельных углеводородов голубое. Массовая доля
углерода в алкенах несколько выше, чем в алканах с тем же числом атомов углерода.
При недостатке кислорода
Слайд 83
Лабораторные способы получения алкенов
При получении алкенов необходимо учитывать
правило А.М. Зайцева: при отщеплении галогеноводорода или воды от
вторичных и третичных галогеналканов или спиртов атом водорода отщепляется от наименее гидрированного атома углерода.
Дегидрогалогенирование галогеналкенов.
Н3С ─ СН2─ СНСl ─ СН3 + КОН → Н3С ─ СН ═ СН ─ СН3 + КСl + Н2О
2-хлорбутан бутен-2
Условия реакции: нагревание.
Дегидратация спиртов.
Н3С ─ СН2 ─ ОН → Н2С ═ СН2 + Н2О
этанол этен
Условия реакции: катализатор – Н2SO4(конц.), t = 180ºС.
Дегалогенирование дигалогеналканов.
Н3С ─ СНCl ─ СН2Сl + Мg → Н3С─СН ═ СН2 + MgCl2
1,2-дихлорпропан пропен
Слайд 84
Промышленные способы получения алкенов
Крекинг алканов.
С10Н22
С5Н12 + С5Н10
Декан пентан пентен
Условия реакции: температура и катализатор.
Дегидрирование алканов.
СН3 – СН2 – СН3 СН2 ═ СН – СН3 + Н2
пропан пропен
Условия реакции: t = 400-600ºС и катализатор (Ni, Pt, Al2O3 или Cr2O3).
Гидрирование алкинов.
CН ≡ СН + Н2 СН2 ═ СН2
этин этен
Условия реакции: катализатор – Pt, Pd, Ni.
Слайд 85
Качественные реакции на двойную углерод-углеродную связь
Обесцвечивание бромной воды.
СН2
= СН – СН3 + Вr2 CH2Br
– CHBr – CH3
пропен 1,2-дибромпропан
Обесцвечивание раствора перманганата калия.
3СН2 = СН – СН3 + 2КМnО4 + 4Н2О
пропен
1 2 3
3СН2ОН – СНОН – СН3 + 2МnО2 + 2КОН
пропандиол-1,2
2 3
4 5 6
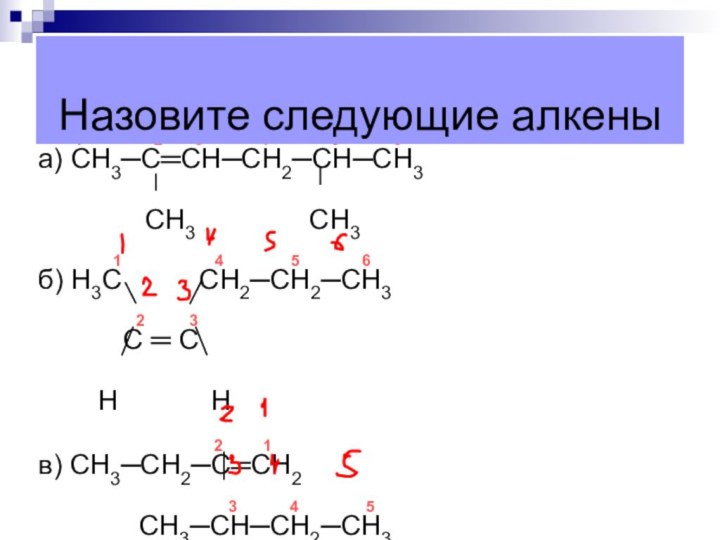
а) СН3─С═СН─СН2─СН─СН3
СН3 СН3
1 4 5 6
б) Н3С СН2─СН2─СН3
2 3
С ═ С
Н Н
2 1
в) СН3─СН2─С═СН2
3 4 5
СН3─СН─СН2─СН3
Назовите следующие алкены
Слайд 87
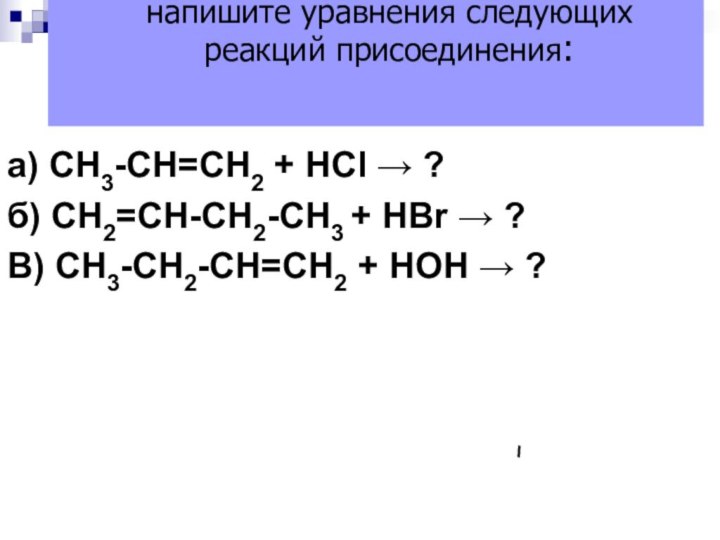
а) СН3-СН=СН2 + НСl → ?
б) СН2=СН-СН2-СН3 +
НBr → ?
В) СН3-СН2-СН=СН2 + НОН → ?
Используя правило
Марковникова, напишите уравнения следующих реакций присоединения:
Слайд 88
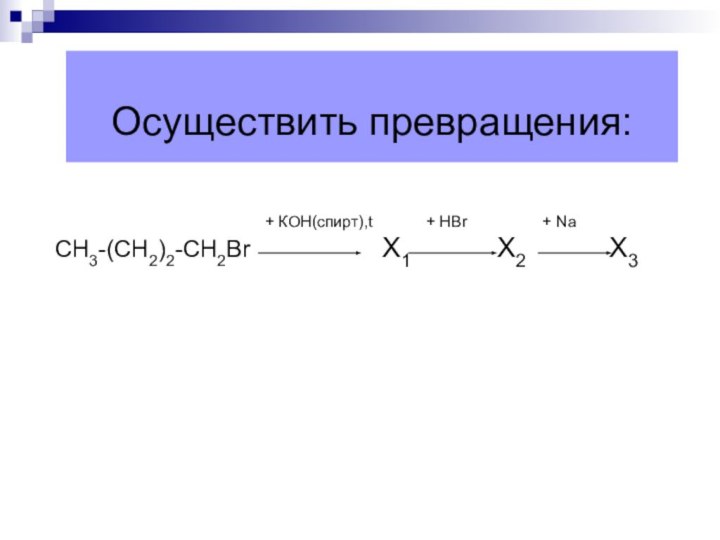
Осуществить превращения:
+
КОН(спирт),t + НBr + Na
СН3-(СН2)2-СН2Br Х1 Х2 Х3
Слайд 89
Непредельные углеводороды
CnH2n-2
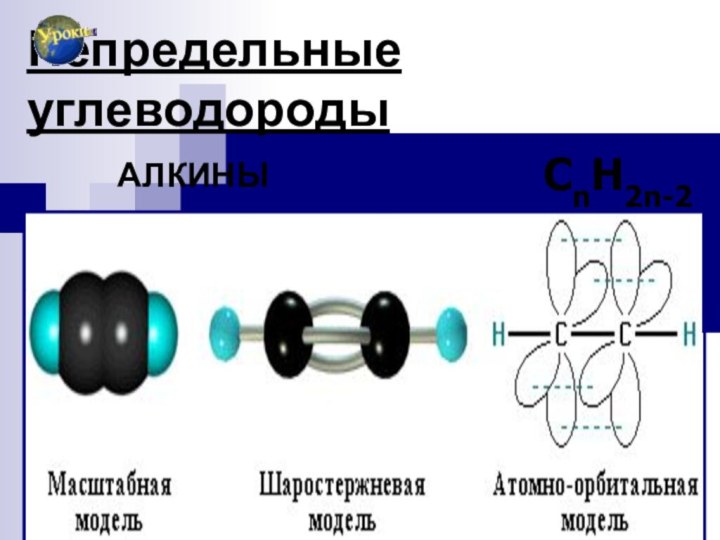
АЛКИНЫ
Слайд 92
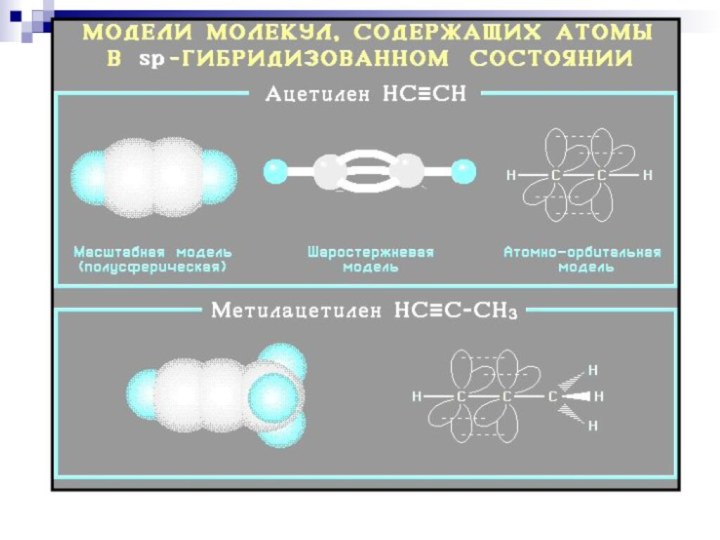
СТРОЕНИЕ
АЦЕТИЛЕН С2Н2 НС≡СН
SP
гибридизация
Слайд 93
СТРОЕНИЕ
sp- Гибридные орбитали двух атомов углерода в состоянии,
предшествующем
образованию тройной связи и связей C–H
Схематическое изображение строения
молекулы ацетилена (ядра атомов
углерода и водорода на одной прямой, две p- связи между атомами углерода
находятся в двух взаимно перпендикулярных плоскостях)
Слайд 95
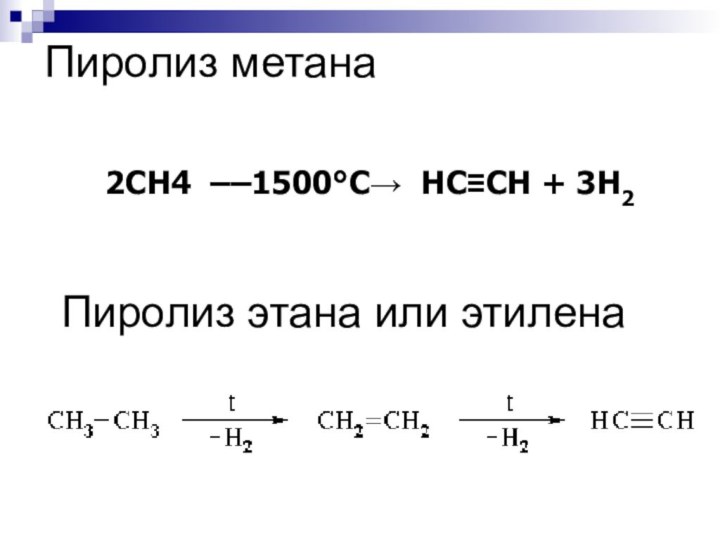
Пиролиз метана
2CH4 ––1500°C→ HC≡CH + 3H2
Пиролиз этана или этилена
Слайд 96
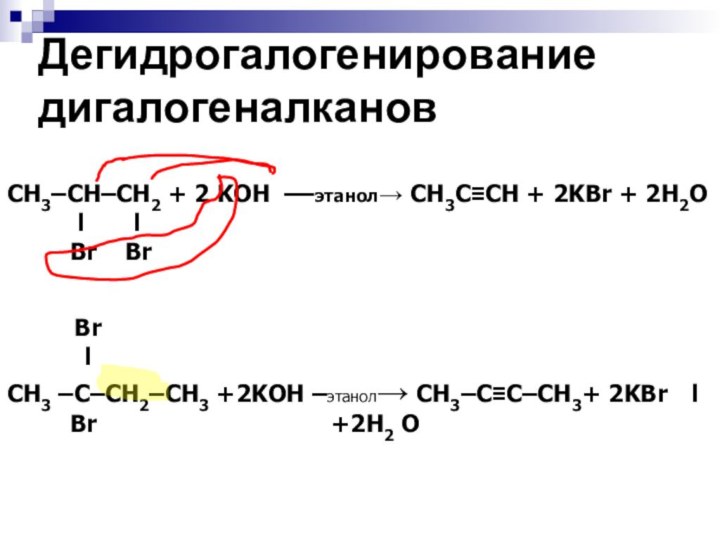
Дегидрогалогенирование
дигалогеналканов
СH3–CH–CH2 + 2 KOH ––этанол→ СН3C≡CH + 2KBr +
2H2O
l l
Br Br
Br
l
CH3 –C–CH2–CH3 +2KOH –этанол→ CH3–C≡C–СH3+ 2KBr l
Br +2H2 O
Слайд 97
Гидролиз ацетелинида кальция
CaC2 + 2H2 O → Ca(OH)2
+ HC≡CH
Слайд 100
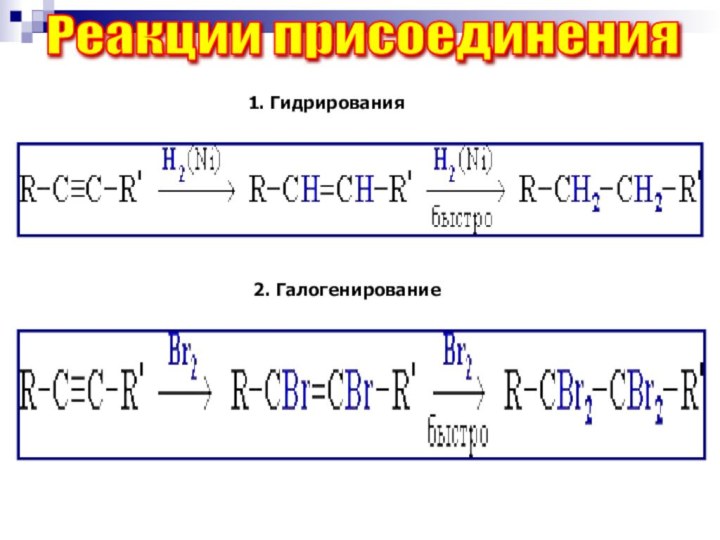
Реакции присоединения
1. Гидрирования
2. Галогенирование
Слайд 102
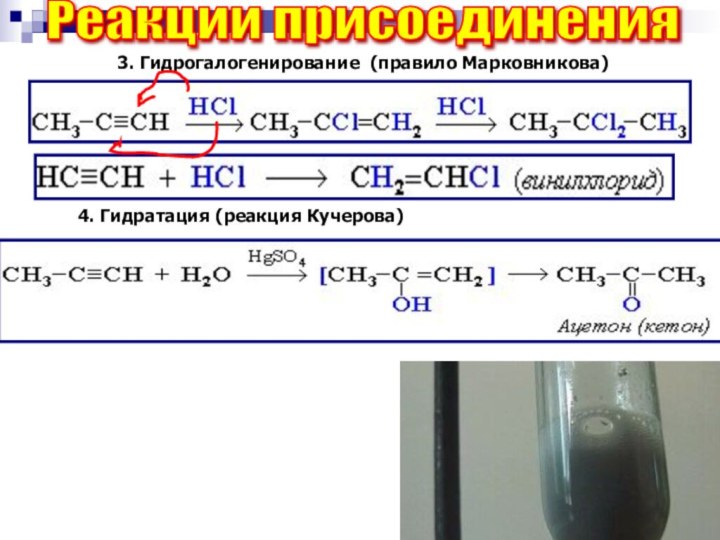
Реакции присоединения
3. Гидрогалогенирование (правило Марковникова)
4. Гидратация (реакция Кучерова)
Слайд 103
5. Реакции полимеризации
А) Димеризация под действием водно-аммиачного раствора
CuCl2
В) Тримеризация ацетилена над активированным углем
(реакция Зелинского)
Слайд 104
Реакции окисления
1.Окисление перманганатом калия КМnO4
1.Реакция полного окисления –
горения.
Слайд 106
Кислотные свойства алкинов
Ацетилен и его гомологи с концевой
тройной связью (алкины-1) вследствие
полярности связи С(sp)-Н проявляют слабые
кислотные свойства: атомы
водорода могут замещаться атомами металла. При этом образуются соли
– ацетилениды
При взаимодействии ацетилена с аммиачными растворами оксида серебра
или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:
Слайд 109
Кислотные свойства алкинов
Ацетилениды разлагаются при действии кислот:
Если
тройная связь находится не на конце цепи, то кислотные
свойства
отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются:
Слайд 112
История открытия
Впервые бензол описал немецкий химик Иоганн Глаубер,
который получил это соединение в 1649 году в результате
перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен.
Слайд 113
Второе рождение
Своё второе рождение бензол получил благодаря
работам Фарадея. Бензол был открыт в 1825 году английским
физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа.
Слайд 114
Новое получение
В 1833 году немецкий физико-химик Эйльгард
Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной
кислоты (именно от этого и произошло название бензол)
Слайд 115
Строение бензола
В свое время было
предложено много
вариантов структурных
формул
бензола, но ни
одна из них не смогла
удовлетворительно
объяснить его
особые
свойства.
Цикличность строения
бензола подтверждается
тем фактом, что его
однозамещенные
производные не имеют
изомеров.
Слайд 116
Схема перекрывания облаков в молекуле
Слайд 117
Квантовомеханическая теория и молекула бензола
Немецкий химик Э. Хюккель
применил к ароматическим соединениям квантовомеханическую теорию и показал, что
шесть π-электронов молекулы бензола располагаются в плоскости, перпендикулярной плоскости
молекулы, взаимно перекрываются и образуют замкнутое электронное облако.
Слайд 118
Физические свойства
Бензол представляет собой бесцветную, легкоподвижную жидкость
с температурой кипения +80ºС и температурой плавления + 5ºС.
Он
обладает своеобразным запахом, горит сильно коптящим пламенем, легче воды и не растворяется в ней.
Пары бензола с воздухом образуют взрывчатую смесь.
Слайд 119
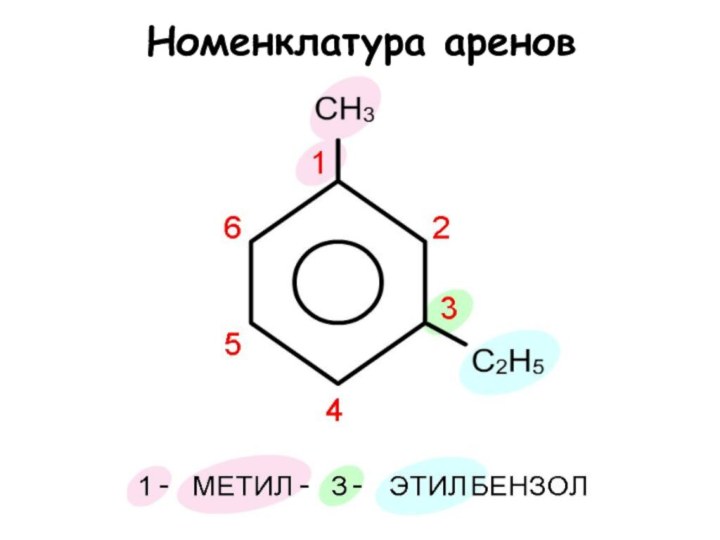
Физические свойства аренов
В обычных условиях низшие
арены - бесцветные жидкости, с характерным запахом. Они не
растворимы в воде, но хорошо растворимы в неполярных растворителях: эфире, четыреххлористом углероде, лигроине. Температуры плавления аренов зависят от степени симметричности молекулы. Чем выше симметрия, тем выше температура плавления.
Слайд 125
Химические свойства
1.Горение бензола:
2С6Н6 + 15О2 = 12СО2
+ 6Н2О +Q
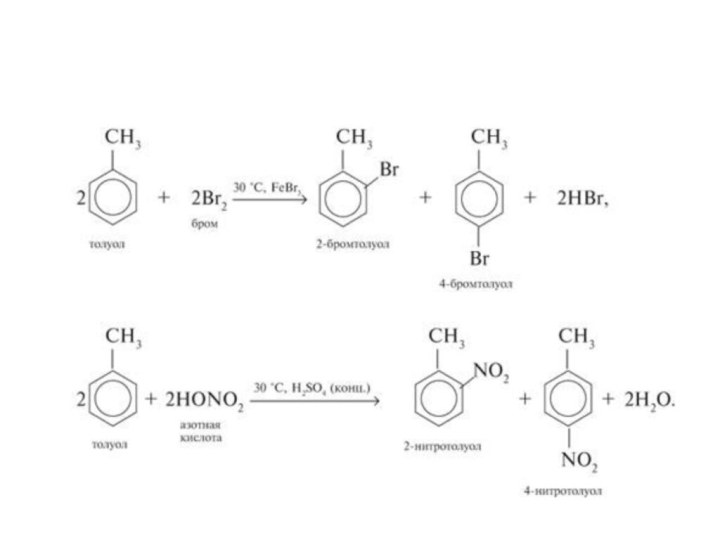
2. Реакция замещения:
С6Н6 + Br2
C6H5Br + HBr
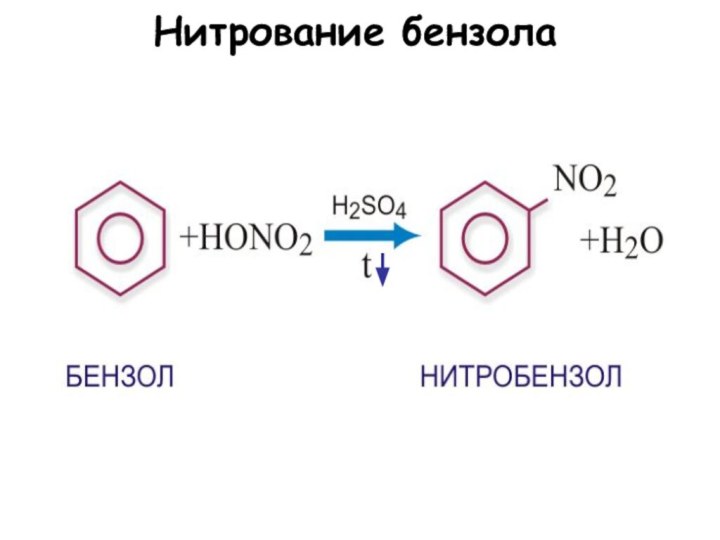
3. Нитрование:
С6Н6 + НОNО2 С6Н5NО2 + Н2О
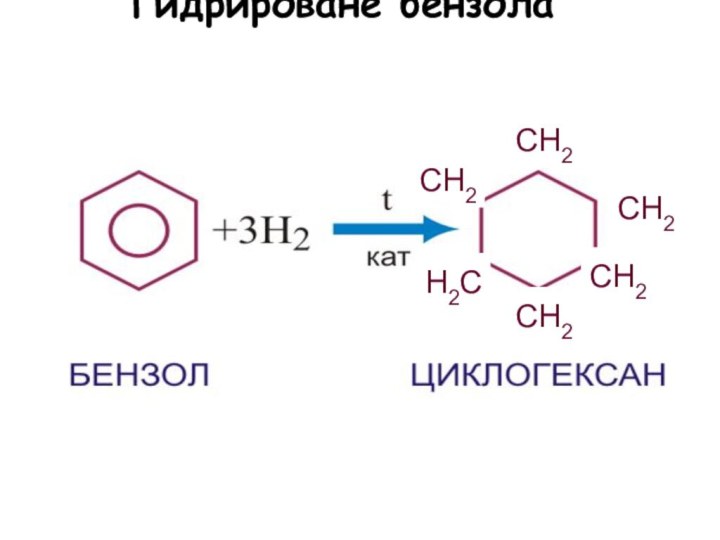
4. Гидрирование:
С6Н6 + 3Н2 С6Н12
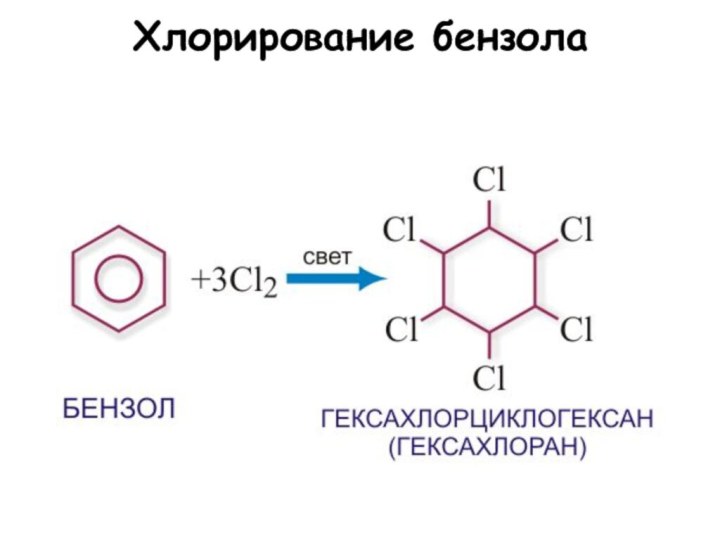
5. Хлорирование:
С6Н6 + 3 Cl2 C6H6Cl6
Слайд 127
Гидрироване бензола
СН2
СН2
СН2
СН2
СН2
Н2С
Слайд 131
Получение
Бензол получают из каменноугольной смолы, образующейся при коксовании
угля.
В настоящее время бензол получают из нефти.
Бензол получают синтетическими
методами.
Слайд 132
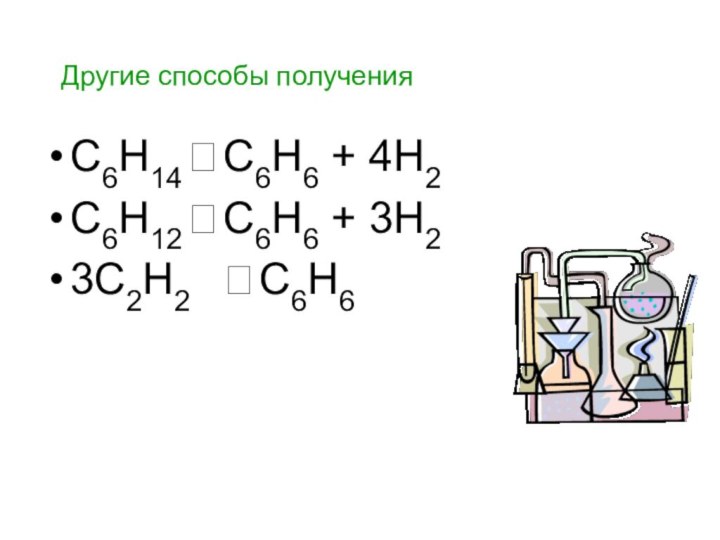
Другие способы получения
С6Н14 ? С6Н6 + 4Н2
С6Н12 ? С6Н6 + 3Н2
3С2Н2 ? С6Н6
Слайд 138
Николай Дмитриевич Зелинский
1861 – 1953 гг.
Русский
химик, академик. Основал большую школу исследователей в области органического
катализа, в которой ему принадлежат классические работы. Важное народнохозяйственное значение имеют исследования Зелинского в области химии нефти. Он разработал методы получения из нефти ценных углеводородов, служащих исходными материалами для синтеза красителей, искусственного каучука, пластмасс, медикаментов и т. д. Провел исследования по химии белка, которые значительно расширили знания о строении белковых тел.
Слайд 139
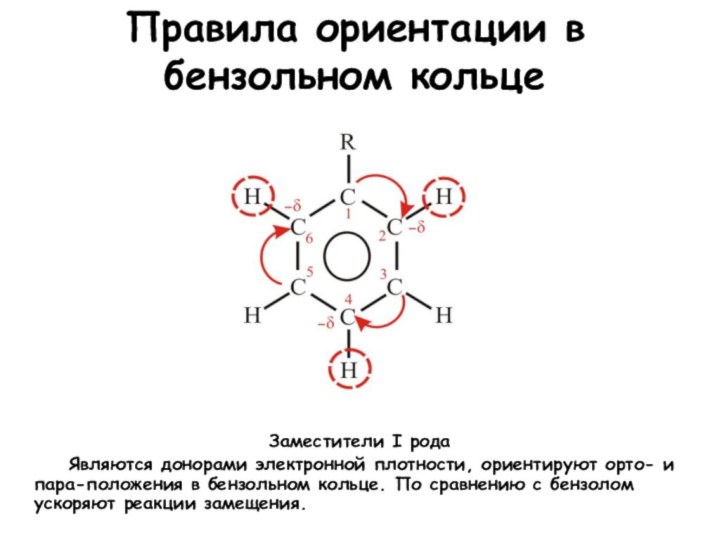
Правила ориентации в бензольном кольце
Заместители I рода
Являются донорами электронной плотности, ориентируют орто- и
пара-положения в бензольном кольце. По сравнению с бензолом ускоряют реакции замещения.
Слайд 140
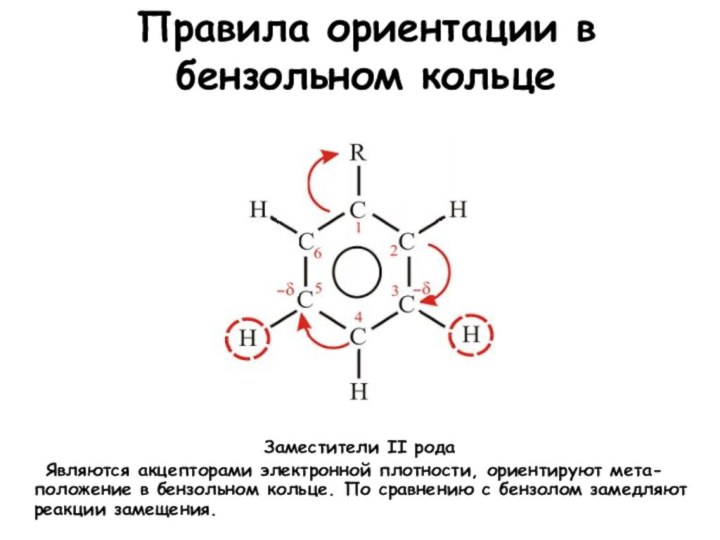
Правила ориентации в бензольном кольце
Заместители II рода
Являются акцепторами электронной плотности, ориентируют мета-положение в бензольном
кольце. По сравнению с бензолом замедляют реакции замещения.