Конкретизировать общие знания учащихся о свойствах кислот.
Выявить характерные
свойства концентрированной серной кислоты, обусловленные наличием в её составе серы высшей степени окисления. Закрепить знания учащихся об окислительно-восстановительных реакциях на примере свойств концентрированной серной кислоты. Рассмотреть экологические проблемы, связанные с производством и применением серной кислоты. Совершенствовать умения учащихся работать с лабораторным оборудованием и реактивами.
Задачи урока:
Образовательные:
актуализировать и обобщить знания учащихся о кислотах , изучить свойства концентрированной серной кислоты, сравнить их со свойствами разбавленной серной кислоты и найти причину этих отличий
рассмотреть специфические химические свойства в свете окислительно-восстановительных реакций.
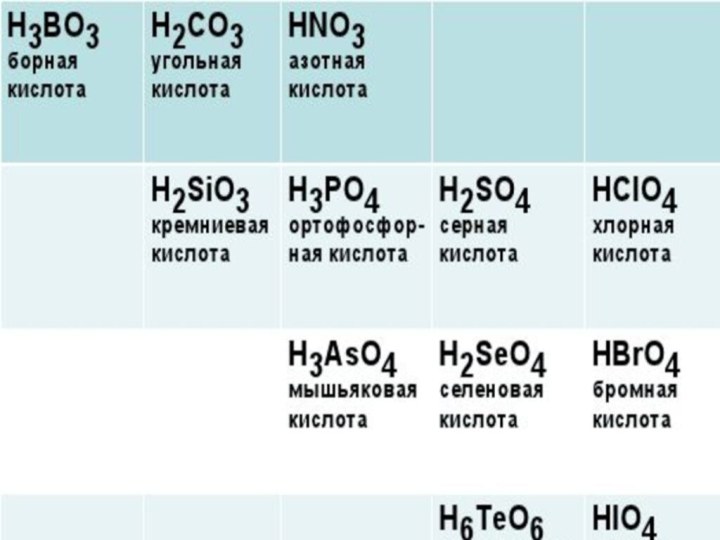
1.Определение кислот
2.Классификацию кислот
Слайд 5
Определение кислоты
В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены
наличием в молекуле атомов кислорода. Эта гипотеза быстро доказала
свою несостоятельность, так как … Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу.
В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота — это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H+)..
Слайд 9
При работе с серной кислотой хорошо подходят слова
Козьмы Пруткова: «Всегда держись начеку». Серная кислота – это
особое вещество
Слайд 11
Серная кислота и близкие к ней продукты - чрезвычайно
токсичные вещества, которым присвоен класс опасности II. Их пары
поражают дыхательные пути, кожу, слизистые оболочки, вызывают затруднение дыхания, кашель, нередко – ларингит, трахеит, бронхит. Предельно допустимая концентрация паров серной кислоты в воздухе рабочей зоны производственных помещений - 1 мг/м3 . Люди, работающие с токсичными кислотами, снабжаются спецодеждой и средствами личной защиты. Концентрированная серная кислота при неаккуратном обращении с ней может вызвать химический ожог.
Слайд 13
Насыпай и наливай только над подносом
Слайд 14
Избегай попадания едких веществ на кожу.
Слайд 15
Попавшие на кожу капли раствора кислоты немедленно смойте
сильной струей холодной воды, а затем обработайте поврежденную поверхность
2%-м раствором питьевой соды (NaHCO3).
Слайд 16
Опыт №1
1.В пробирку поместите 1 мл раствора серной
кислоты
2.Добавьте раствор индикатора -лакмуса, метилового оранжевого
Отчет
Отметьте окраску индикаторов
(Записываем её
диссоциацию по двум ступеням)
Сделайте вывод:
1. Какой ион при диссоциации серной кислоты способствует изменении окраски индикатора.
Слайд 18
Анализ-метод научного исследования ( познания) явлений и процессов,
в основе которого лежит изучение составных частей,
элементов изучаемой системы.
Анализ-это
отправная точка …
Слайд 19
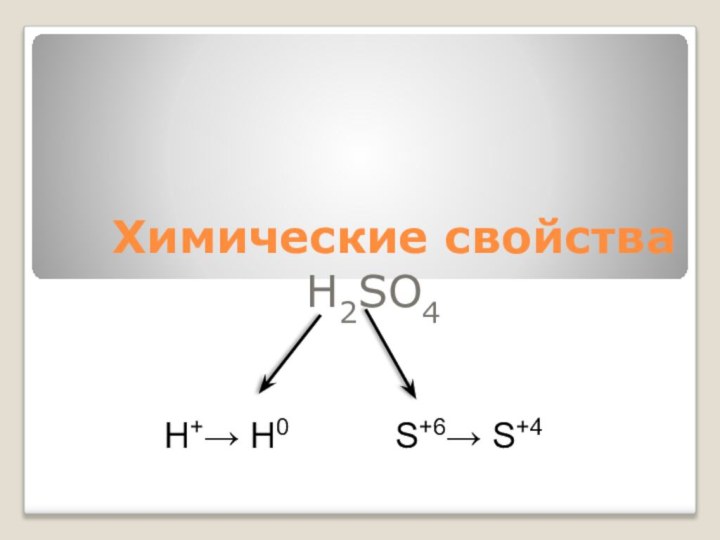
Химические свойства
H2SO4
H+→ H0
S+6→ S+4
Слайд 20
Опыт № 3
Опустите в одну пробирку с
серной кислотой кусочек цинка, в другую медь. Что вы
наблюдаете? Запишите уравнение химических реакций, окислительно-восстановительную реакцию взаимодействия цинка с раствором серной кислоты,опредилите окислитель и восстановитель.
Слайд 22
Вывод: .
Разбавленная серная кислота окисляет металлы, стоящие в
ряду активности до водорода, за счет ионов Н+.
Взаимодействие металлов с разбавленной серной кислотой
Слайд 23
На заводе долгое время перекачивали серную кислоту из
хранилища в цех по стальному трубопроводу.
Но однажды трубы
дали течь, и цех был залит кислотой.
Выяснение обстоятельств аварии показало, что, нарушая правила технологии, трубопровод целый год использовали для транспортировки кислоты, имеющей не 93%, а 45% концентрацию.
Почему изменение концентрации кислоты вызвало коррозию трубопровода? Приведите уравнение реакции.
Слайд 24
Взаимодействие металлов концентрированной серной кислотой.
В зависимости от активности
металла, и от условий протекания реакций могут выделяться SO2,
S, H2S:
При обычных условиях:
Взаимодействие активных металлов с конц. серной кислотой (Li – Zn)
8Na + 5H2SO4(k) = 4Na2SO4 + H2S + 4H2O (соль, H2S, H2O)
.
Взаимодействие металлов средней активности с конц. серной кислотой (Cd – Pb).
3Ni + 4H2SO4(k) = 3NiSO4 + S + 4H2O (соль, S, H2O)
Слайд 25
Взаимодействие пассивных металлов с конц. серной кислотой (Me,
стоящие в ряду напряжений металлов после H2, Fe)
Cu + 2H2SO4(k) = (соль, SO2, H2O)
Слайд 26
5SO2 + 2KMnO4 +2H2O = 2MnSO4 + K2SO4 + 2H2SO4
Пропустим полученный газ
через раствор перманганата калия.
Происходит обесцвечивание раствора из-за восстановления сернистым
газом фиолетового перманганат-иона до бесцветного катиона Mn2+.
Слайд 27
Вывод: У концентрированной серной кислоты окислителем является элемент
образующий кислотный остаток - SO42- , за счет атома серы
в максимальной степени окисления. Окислительные свойства SO42- значительно выше, чем иона водорода Н+, поэтому концентрированная серная кислота взаимодействует практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после водорода, кроме золото и платины, также с многими неметаллами. Так как окислителем в концентрированной серной кислоте является ион кислотного остатка, за счет атома серы в степени окисления +6, а не ион водорода то при взаимодействии с концентрированной серной кислоты с металлами водород не выделяется.
Слайд 28
Серная кислота и органические вещества
Слайд 29
Серная кислота - сильное водоотнимающее средство: она отнимает
молекулы воды даже от органических соединений. Погруженная в кислоту,
обугливается, а при попадании капель такой кислоты на бумагу происходит обугливание и разъедание бумаги:
(C6H10O5)n + H2SO4 =>
древесина, бумага
Слайд 30
Взаимодействие с сахарозой
C12H22O11 + 2Н2SO4к.= 2SO2 + 13H2O+11C
+ CO2
Слайд 31
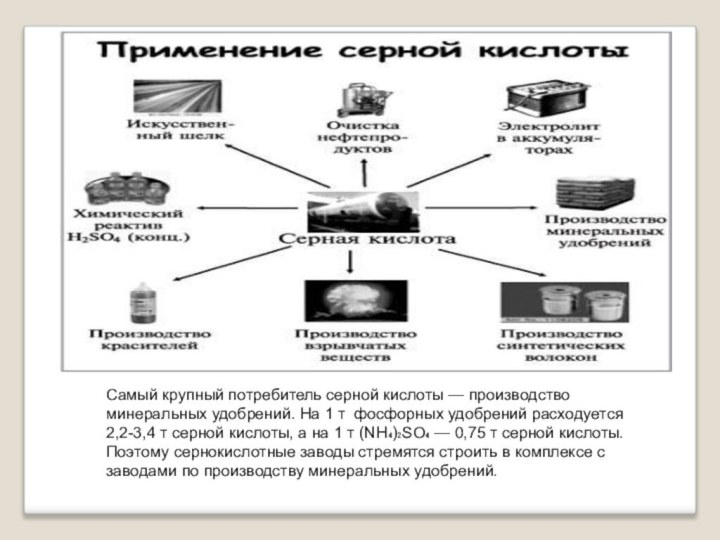
Самый крупный потребитель серной кислоты — производство минеральных удобрений.
На 1 т фосфорных удобрений расходуется 2,2-3,4 т серной
кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Слайд 32
Медный купорос CuSO4•5Н2O широко используют в сельском хозяйстве для борьбы
с вредителями растений.
.
Слайд 33
Железный купорос FеSО4•7Н2O применяли раньше для лечения чесотки, гельминтоза и
опухолей желез, в настоящее время используют для борьбы с
сельскохозяйственными вредителями.
Слайд 34
Глауберова соль» (мирабилит) Nа2SO4•10Н2O была получена немецким химиком И. Р. Глаубером
при действии серной кислоты на хлорид натрия, в медицине
ее используют как слабительное средство.
Слайд 35
Бариевая каша» BaSO4 обладает способностью задерживать рентгеновские лучи в значительно
большей степени, чем ткани организма. Это позволяет рентгенологам при
заполнении «бариевой кашей» полых органов определить в них наличие анатомических изменений.
Слайд 36
Гипс СаSO4•2Н2O находит широкое применение в строительном деле, в медицинской
практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.
Слайд 39
В новое тысячелетиеВ новое тысячелетие человечество вступило в условиях экологического кризисаВ новое тысячелетие человечество

вступило в условиях экологического кризиса. До ноосферы Вернадского как сферы коллективного разума
на Земле еще очень далеко. В настоящее время выделяют три
глобальные экологические проблемы глобальные экологические проблемы – разрушение озонового слоя глобальные экологические проблемы – разрушение озонового слоя Земли, прогрессирующее потепление ее климата глобальные экологические проблемы – разрушение озонового слоя Земли, прогрессирующее потепление ее климата и кислотные дожди глобальные экологические проблемы – разрушение озонового слоя Земли, прогрессирующее потепление ее климата и кислотные дожди – сделали вполне реальной угрозу самоуничтожения человечества. Еще в конце 19 века Энгельс предупреждал: «Не будем, однако, слишком обольщаться нашими победами над природой. За каждую такую победу она нам мстит. Каждая из этих побед имеет, правда, в первую очередь те последствия, на которые мы рассчитывали, но во вторую и третью очередь совсем другие, непредвиденные последствия, которые очень часто уничтожают последствия первых».
Проверь себя!
2. Зимой между рамами окон иногда помещают
сосуд с концентрированной серной кислотой. С какой целью это делают, почему сосуд нельзя заполнять кислотой доверху?
3. Концентрированная серная кислота при нагревании реагирует с серебром, подобно тому, как она реагирует с медью. Составьте уравнения этих реакций и укажите окислитель и восстановитель.
1.«Слово «кислота» - это функция вещества, а не этикетка с названием», - говорил российский химик Иван Владимирович Тананаев. Что он имел в виду?
Слайд 42
7.Итоги урока: Целью нашего урока было:
-изучить свойства
концентрированной серной кислоты, сравнить их со свойствами разбавленной серной
кислоты и найти причину этих отличий.
-закрепить знания учащихся об окислительно-восстановительных реакциях на примере свойств концентрированной серной кислоты.
- рассмотреть экологические проблемы, связанные с производством и применением серной кислоты.
Какова же главная причина отличительных свойств концентрированной серной кислоты?
Таким образом, цель урока ……..
Слайд 43
Домашнее задание:
1.п.31, стр. 132-133
2Диоксид серы образуется в основном
при сжигании твердого топлива на тепловых электростанциях. Это бесцветный
газ с резким запахом, он сильно раздражает слизистые оболочки глаз и дыхательных путей. Наличие диоксида серы в атмосфере — причина кислотных дождей, поскольку под действием кислорода воздуха и воды диоксид серы превращается в серную кислоту. Однако далеко не все производства, в выбросах которых содержится диоксид серы, имеют современные сооружения для газоочистки. Чаще применяется разбавление выбросов чистым воздухом или рассеивание их в воздушной среде путем устройства дымовых труб большой высоты. Установлено, что при высоте трубы 100 м на расстоянии 2 км от предприятия содержание диоксида серы в воздухе равно 2,75 мг/м3. Во сколько раз этот показатель превышает значение предельно допустимой концентрации, равное 7,8∙10-6 моль/м3.
Оценка работы учащихся
Слайд 44
V. Рефлексия.
Выберите себе понравившееся начало предложения и завершите
его
Сегодня узнал(а), что могу _______________________________
Я считаю полезным _____________________________________
Мне понравилось
_______________________________________
Мне было трудно ________________________________________
Теперь бы я хотел(а) еще узнать____________________________
Слайд 46
«СКАЖИ МНЕ – И Я ЗАБУДУ,
ПОКАЖИ МНЕ –
И Я ЗАПОМНЮ,
ДАЙ МНЕ ДЕЙСТВОВАТЬ САМОМУ –
И
НАУЧУСЬ
(китайская мудрость)
Слайд 51
Теоретические основы окислительно –
восстановительных свойств серной
кислоты
Слайд 52
презентация « Серная кислота и экологические проблемы
Слайд 55
Диоксид серы образуется в основном при сжигании твердого
топлива на тепловых электростанциях. Это бесцветный газ с резким
запахом, он сильно раздражает слизистые оболочки глаз и дыхательных путей. Наличие диоксида серы в атмосфере — причина кислотных дождей, поскольку под действием кислорода воздуха и воды диоксид серы превращается в серную кислоту. Однако далеко не все производства, в выбросах которых содержится диоксид серы, имеют современные сооружения для газоочистки. Чаще применяется разбавление выбросов чистым воздухом или рассеивание их в воздушной среде путем устройства дымовых труб большой высоты. Установлено, что при высоте трубы 100 м на расстоянии 2 км от предприятия содержание диоксида серы в воздухе равно 2,75 мг/м3. Во сколько раз этот показатель превышает значение предельно допустимой концентрации, равное 7,8∙10-6 моль/м3.