- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Серная кислота
Содержание
- 2. ИсторияАлхимики получили в Х веке кислоту. В
- 3. Физические свойстватяжелая жидкостьтвердая при10*Сгигроскопичнаяразлагается при 200*Собразует азеотропплотность 1,8 г/млкипит с перегонкой при 336,5*С
- 4. РастворимостьПоглощает влагу, выделяя огромное
- 5. Нельзя прибавлять воду к кислоте.
- 6. Медленно прибавить кислоту к воде !!!
- 7. Диссоциация серной кислотыИдет в 2 стадии,т.е. ступенчато H2SO4=H++HSO4-HSO4-=H++SO42-
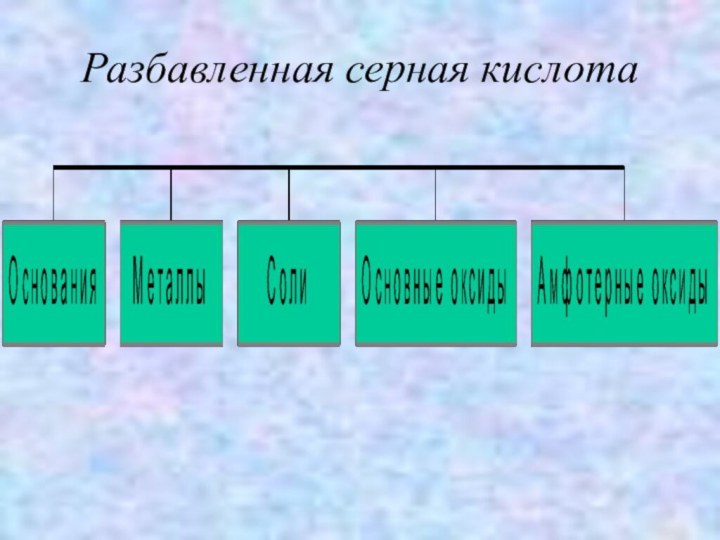
- 8. Разбавленная серная кислота
- 9. Характерные свойства
- 11. С металлами:2Na+H2SO4=Na2SO4+H2C основными оксидами:Na2O+H2SO4=Na2SO4 +H2OC амфотерными оксидами:Al2O3+3H2SO4=Al2(SO4)3+3H2OC основаниями - со щелочами-реакция нейтрализации:2NaOH+H2SO4=Na2SO4+2H2OС нерастворимыми гидроксидами:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
- 12. С солями слабых кислот,если выделяется газ:Na2CO3+H2SO4=Na2SO4+H2O+CO2С нерастворимыми солями:Ca3(PO4)2+3H2SO4=3CaSO4+2H3PO4Со щелочами-кислые соли образует:NaOH+H2SO4=NaHSO4+H2OC индикаторами:лакмус-красныйметилоранж-красныйфенолфталеин-бесцветный
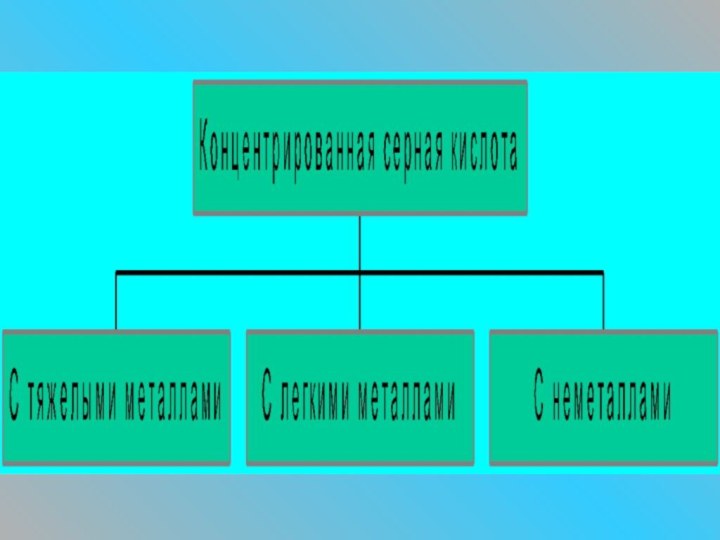
- 13. Специфические свойства
- 15. Кислота- сильный окислитель:С тяжелыми металлами:Сu+2H2SO4=CuSO4+SO2+2H2OC легкими металлами(зависимость от концентрации кислоты, от актив-ности восстановителя):Zn+2H2SO4=ZnSO4+SO2+2H2O3Zn+4H2SO4=3ZnSO4+S+4H2O4Zn+5H2SO4=4ZnSO4+H2S+4H2O
- 16. С неметалламиРастворение углерода,серы,фосфора:C+2H2SO4=CO2++2SO2+2H2OS+2H2SO4=3SO2+ +2H2Oобугливает сахар
- 17. Отличие свойствКонцентрирован- ная кислота почти не
- 18. Транспортировка серной кислоты
- 19. Применение серной кислотыПолучение нитокОтбеливание ткани
- 20. ПрименениеПроизводство моющих средствПолучение лекарств
- 21. Скачать презентацию
- 22. Похожие презентации
ИсторияАлхимики получили в Х веке кислоту. В ХV веке из купо- росов и серы начали получать . Поэтому и называют серную кислоту купоросное масло.