Слайд 2
Спирты – это производные углеводородов, содержащие одну или
несколько гидроксильных групп (-ОН)
Общая формула спиртов: СnH2n+2O
Историческое название:
алкоголи
Название по ИЮПАК: алканолы
Слайд 3
Классификация спиртов
1.По числу гидроксильных групп: одноатомные - CH3OH
(метанол)
Двухатомные - CH2OHCH2OH – этиленгликоль
Трехатомные -CH2OHCHOHCH2OH
(глицерин)
Многоатомные - CH2OHCHOHCHOHCHOHCHOHCH2OH
(сорбит)
Слайд 4
2.По характеру УВ- радикала:
Предельные СnH2n+2O
Непредельные (содержащие ═
или ≡ связи)
Ароматические (содержащие в молекуле бензольное кольцо)
3.По характеру
углеродного атома:
Первичные: CH3OH - метанол
Вторичные:CH3CHOH CH3 - пропанол-2
Третичные
Слайд 5
Гомологический ряд одноатомных, предельных спиртов
CH3OH – метанол, метиловый
спирт, древесный спирт
C2H5OH – этанол, этиловый спирт, винный спирт
C3H7OH
– пропанол – пропиловый спирт
C4H9OH – бутанол, бутиловый спирт
C5H11OH – пентанол, пентиловый спирт, амиловый спирт
Слайд 6
Изомерия спиртов
Изомерия положения функциональной группы
Изомерия углеродного скелета
Межклассовая изомерия
– изомерны простым эфирам
Слайд 7
Физические свойства спиртов
Между молекулами спиртов существует слабая межмолекулярная
связь – водородная, поэтому:
Спирты хорошо растворяются в воде
У
них повышенная температура кипения и плавления
Спирты могут в жидком или твердом агрегатном состоянии
Спирты растворители многих органических и неорганических соединений
Слайд 8
5. Бесцветные
6. Прозрачные
7. Имеют специфический запах
8.Неограниченно смешиваются с
водой
9. ВСЕ СПИРТЫ ЯДОВИТЫ
Слайд 9
Химические свойства спиртов
Взаимодействуют с активными металлами
2Na + C3H7OH→
2C3H7ONa + H2↑
Взаимодействуют с кислотами – реакция этерификации, образуются
сложные эфиры
C3H7OH + CH3COOH →CH3COO C3H7 + H2O
Слайд 10
Взаимодействуют с галогеноводородами
C3H7OH + HCl → C3H7Cl +
H2O
Спирты могут взаимодействовать со спиртами – межмолекулярная дегидратация
C3H7OH +
C3H7OH→C3H7O C3H7 + H2O
Внутримолекулярная дегидратация
C2H5OH→ C2H4 + H2O ( в присутствии серной кислоты, температуре менее 140 градусов)
Слайд 11
ВСЕ СПИРТЫ ПОДВЕРГАЮТСЯ ПОЛНОМУ ОКИСЛЕНИЮ – ГОРЯТ
СnH2n+2O +
3/2nO2→nCO2↑+ (n+1)H2O +Q
Мягкое окисление – окислители KMnO4, K2Cr2O7
( в кислой среде)
Мягкое окисление первичных спиртов
R-CH2-OH ( в присут. KMnO4)→R-CO-H (альдегид) + H2O →RCOOH (карбоновая кислота)
Слайд 12
Вторичные спирты окисляются до кетонов
Третичные спирты устойчивы к
мягкому окислению
Реакции дегидрирования ( отщепления водорода) – первичных спиртов
R-CH2-OH→RCOH
(альдегид) +H2↑(катализатор Cu, повышенная температура)
Вторичных спиртов
R-CHOH-R1 →R-CO-R1 +H2↑
Слайд 13
Качественные реакции на многоатомные спирты
Взаимодействие с Cu(OH)2 приводит
к образованию ярко-синих комплексных соединений
Одноатомные спирты в эту реакцию
не вступают
Слайд 14
Способы получения спиртов
В чистом виде в природе спирты
не встречаются, только в виде производных ( сложных эфиров)
Хотя
спирты являются производными УВ, но непосредственно получить их из алканов трудно
алкан→ галогенпроизводное алканов →гидролиз→ спирт ( на практике этим способом не пользуются)
Слайд 15
Гидролиз галогеналканов
R –Hal +H2O→ R-OH + HHal или
R –Cl +NaOH тв→ R-OH + NaCl ( в
водной среде) – этими способами пользуются редко)
Гидратация алкенов (присоединение по правилу Марковникова)
RCH ═ CH2+ H2O→ RCHOH – CH3 (в кислой среде)
Слайд 16
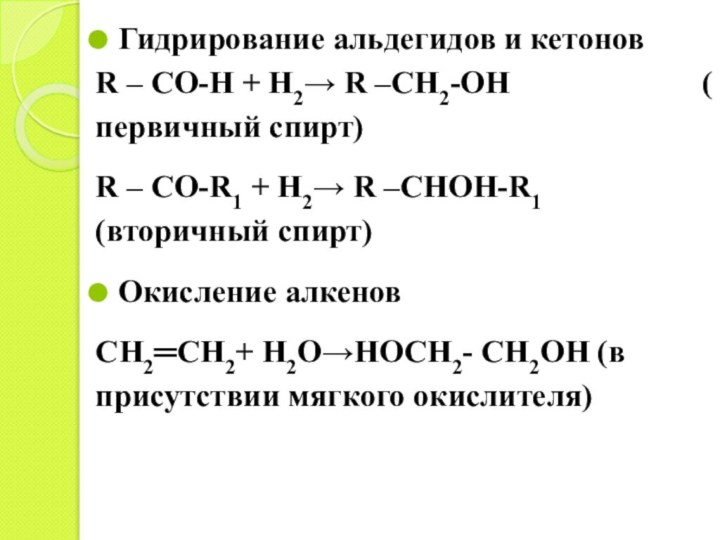
Гидрирование альдегидов и кетонов
R – CO-H + H2→
R –CH2-OH
( первичный спирт)
R – CO-R1 + H2→ R –CHOH-R1 (вторичный спирт)
Окисление алкенов
CH2═CH2+ H2O→HOCH2- CH2OH (в присутствии мягкого окислителя)
Слайд 17
Специфические способы получения спиртов
Получение метанола из синтез газа
CO
+ 2H2→CH3OH ( катализатор ZnO, повышенная температура и давление)
Брожение глюкозы
C6H12O6→2C2H5OH + 2CO2↑(дрожжи)
Гидролиз жиров
Брожение пищевого сырья
Гидролиз древесины – гидролизный спирт