Групи елементів
I
II
VI
V
VII
III
IV
VIII
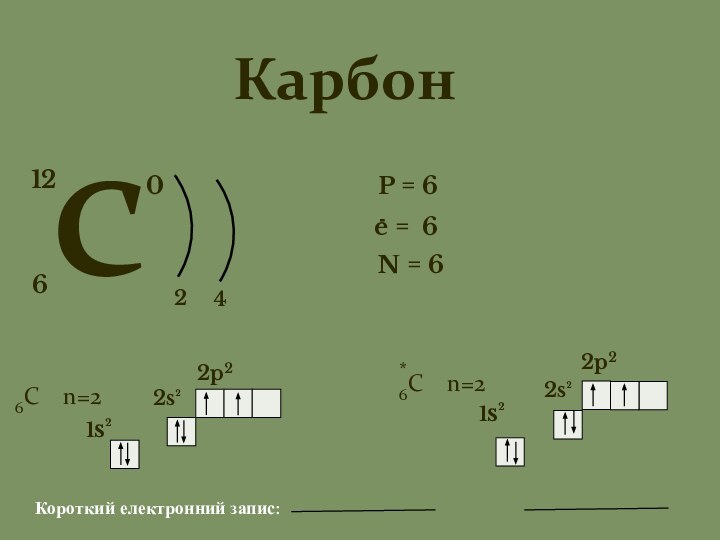
C
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть







I
II
VI
V
VII
III
IV
VIII
C