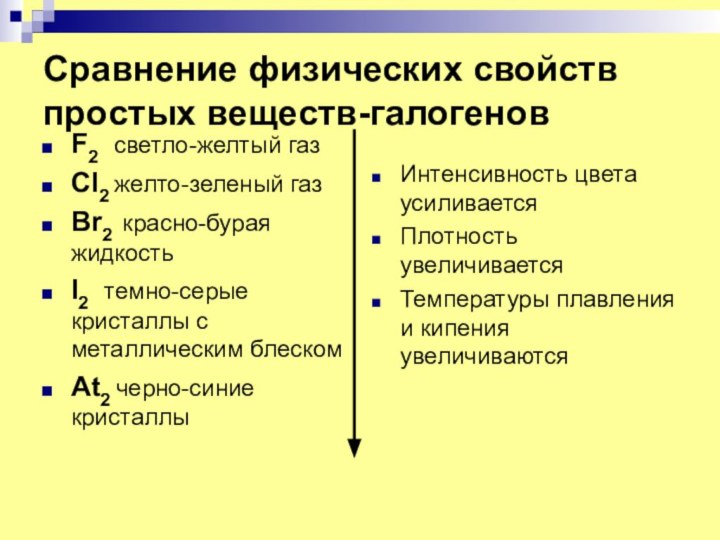
горизонтали). Cl2 + …→FeCl3
5 (по горизонтали). F2+…→HF+O2
10 (по горизонтали).
Роль HCl в реакции:
MnO2 + 4HCl→MnCL2+Cl2+2H2O
12 (по горизонтали).Роль брома в реакции:
Br2 + 2KI →2KBr + I2
13 (по горизонтали). Галоген, являющийся при обычных условиях жидкостью
15 (по горизонтали).Природное соединение состава NaCl
17(по горизонтали). Ученый, открывший хлор
18 (по горизонтали). Цвет осадка AgI
19 (по горизонтали). Металл, нитрат которого используют для определения галогенов
1 (по вертикали). Высшая степень окисления галогенов
(кроме фтора)
2 (по вертикали). Галоген, кристаллы которого имеют черно-фиолетовый цвет с металлическим блеском
3 (по вертикали). Количество атомов в молекулах простых веществ-галогенов
6 (по вертикали). Радиоактивный галоген
7 (по вертикали). Второе название хлороводородной кислоты
8 (по вертикали). Степень окисления простых веществ - галогенов
9 (по вертикали). Элемент VIIА группы
11 (по вертикали). Цвет осадка при качественном определении ионов хлора Cl¯
14 (по вертикали). Br2 + …→CuBr2
16 (по вертикали). Название соли соляной кислоты