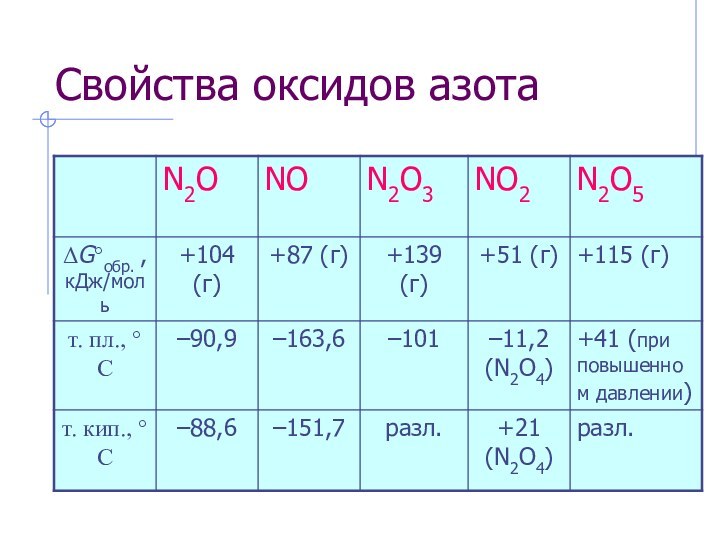
со слабым приятным запахом и слабонаркотическим действием, т.пл. –91
°С, т.кип. –89 °С.N2O – несолеобр. оксид, сильный окислитель.
Разложение:
2N2O = 2N2O + O2
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




![Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы Шкала степеней окисления фосфора P4O10, (HPO3)x, H4P2O7, H3PO4, PГ5, H[PF6] P4O6, H3PO3,](/img/tmb/15/1453766/368e44e62f5147038a03685420e099f5-720x.jpg)



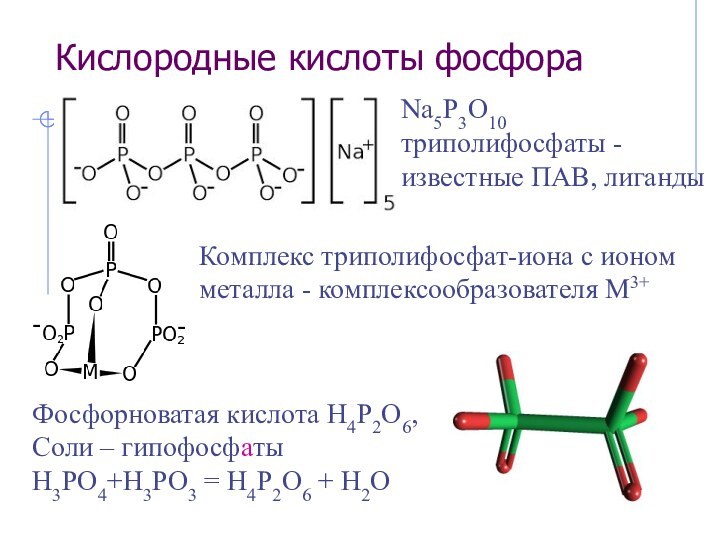


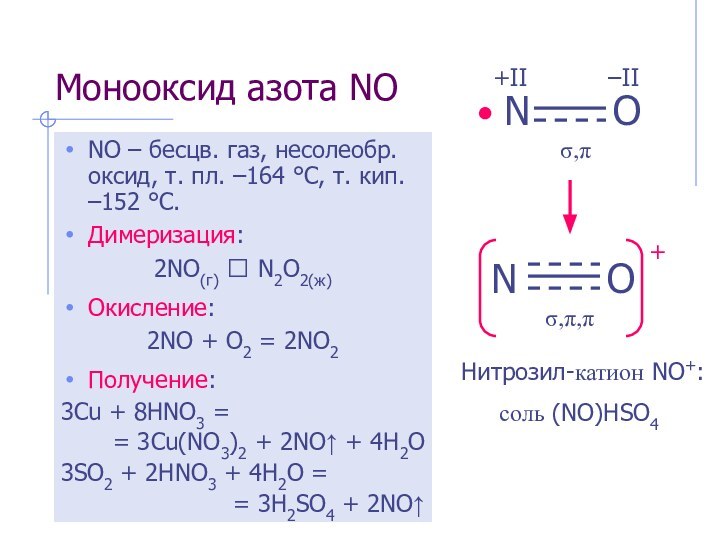
Нитрозил-катион NO+:
соль (NO)HSO4
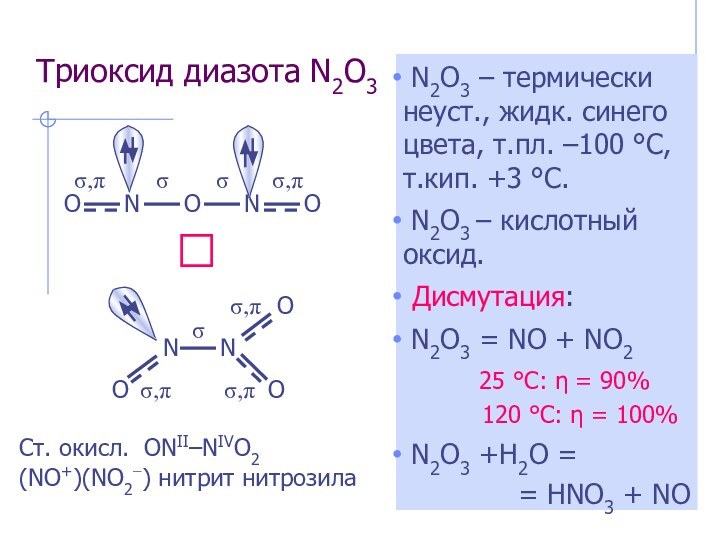
⮃
Ст. окисл. ONII–NIVO2
(NO+)(NO2−) нитрит нитрозила
⮀
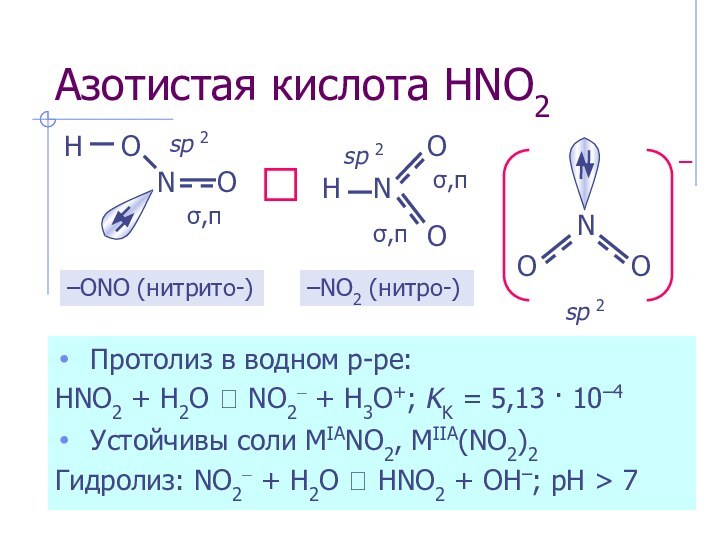
–ONO (нитрито-)
–NO2 (нитро-)
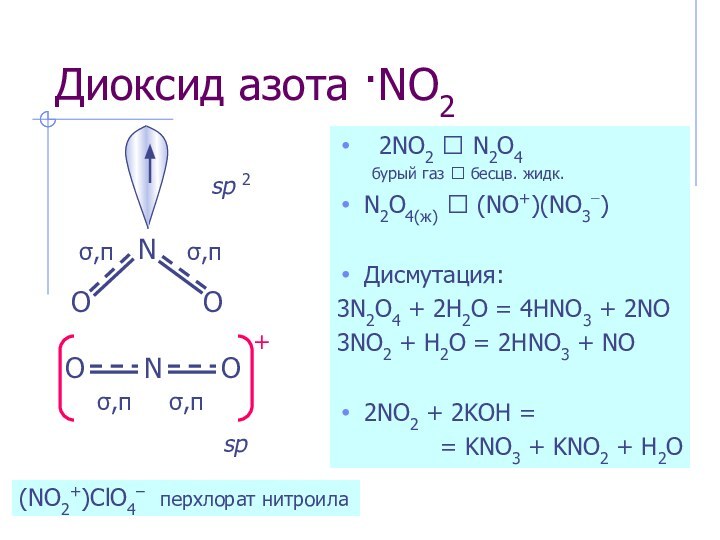
sp 2
sp 2
sp
(NO2+)ClO4– перхлорат нитроила
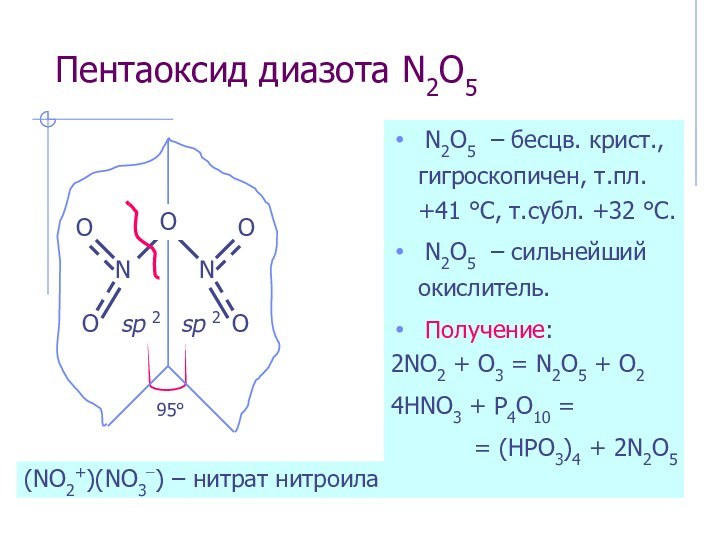
sp 2
sp 2
O
(NO2+)(NO3−) – нитрат нитроила
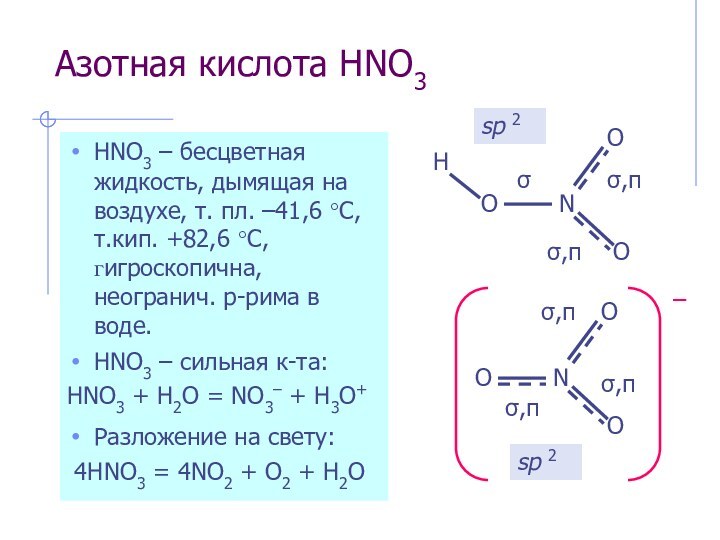
sp 2
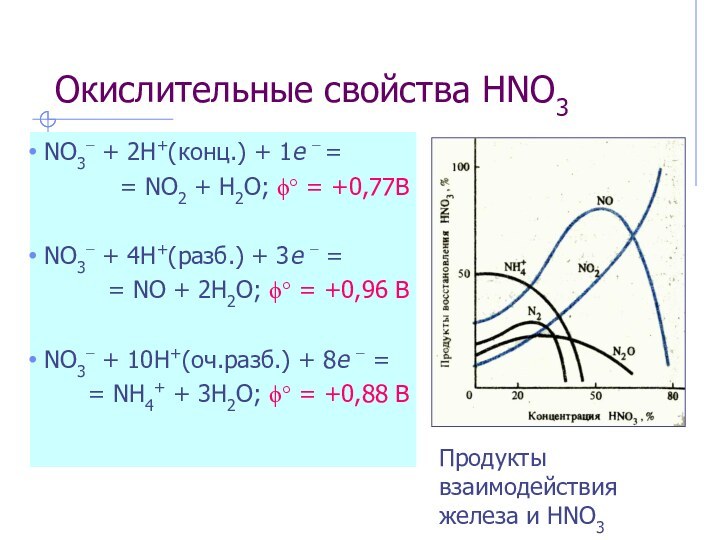
Продукты взаимодействия железа и HNO3
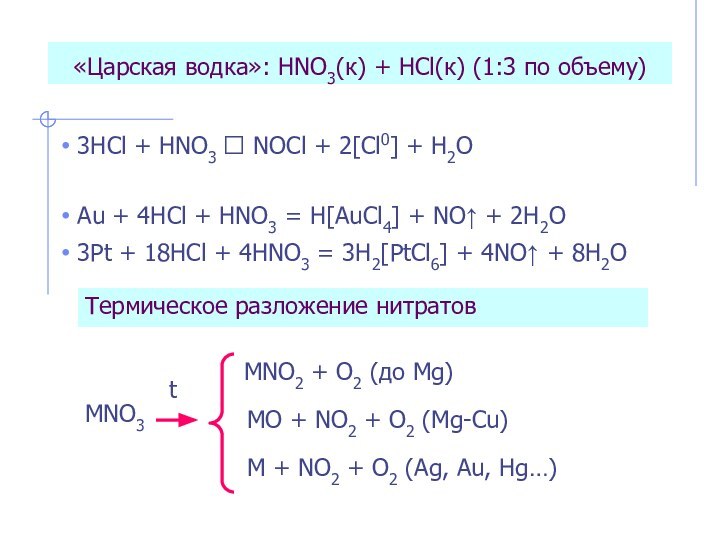
Термическое разложение нитратов
MNO3
MNO2 + O2 (до Mg)
MO + NO2 + O2 (Mg-Cu)
M + NO2 + O2 (Ag, Au, Hg…)
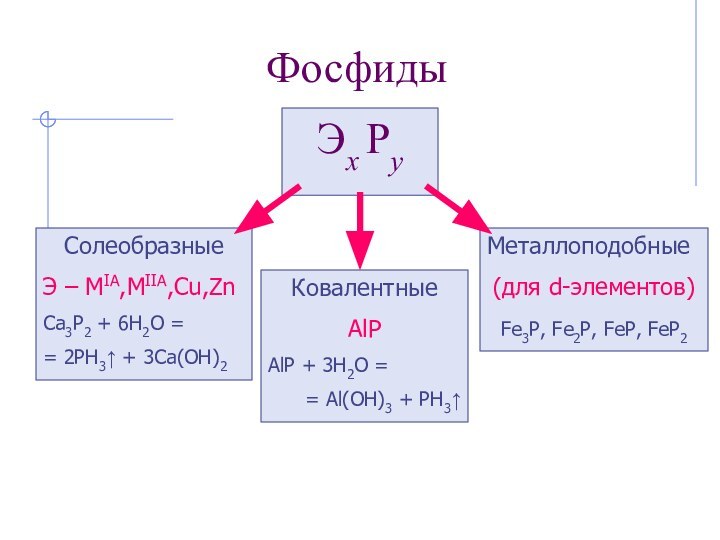
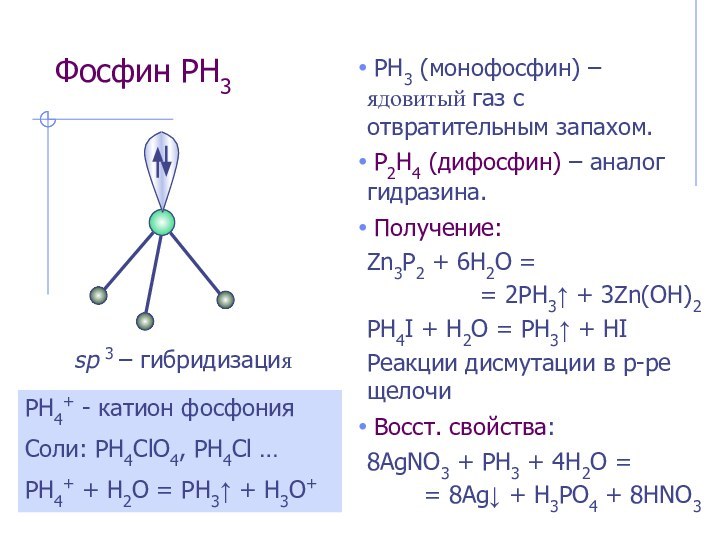
PH3, PH4+, Na3P, Mg3P2, AlP
Металлоподобные
(для d-элементов)
Fe3P, Fe2P, FeP, FeP2
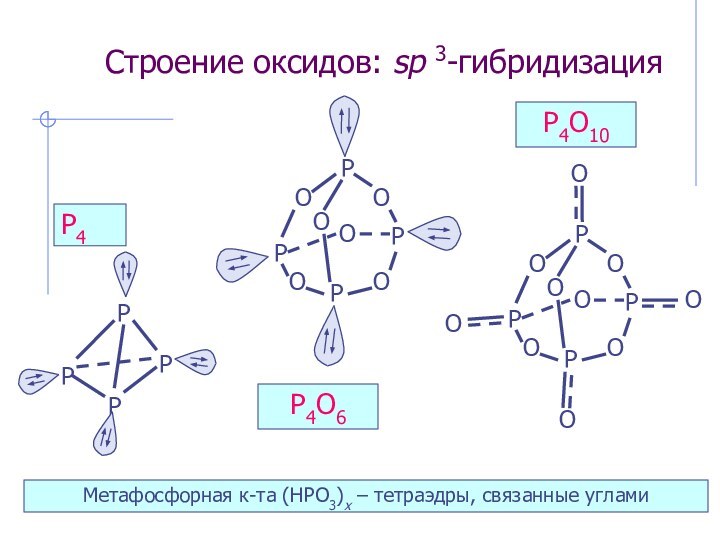
sp 3 – гибридизация
PH4+ - катион фосфония
Соли: PH4ClO4, PH4Cl …
PH4+ + H2O = PH3↑ + H3O+
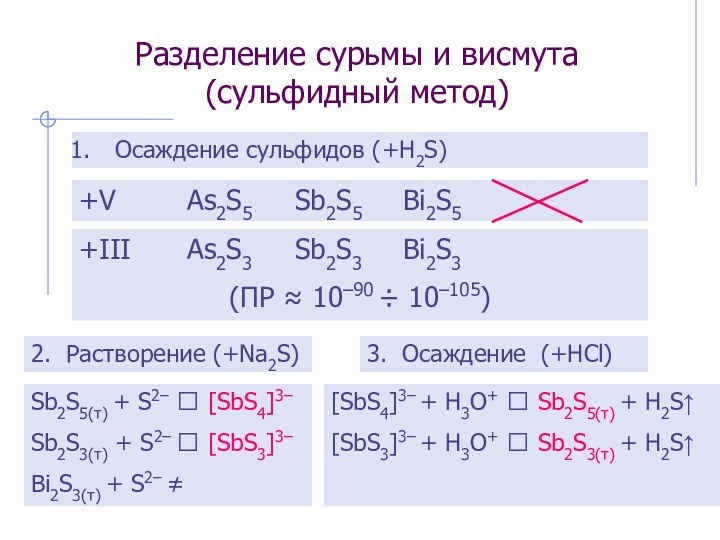
3. Осаждение (+HCl)
[SbS4]3– + H3O+ ⭢ Sb2S5(т) + H2S↑
[SbS3]3– + H3O+ ⭢ Sb2S3(т) + H2S↑