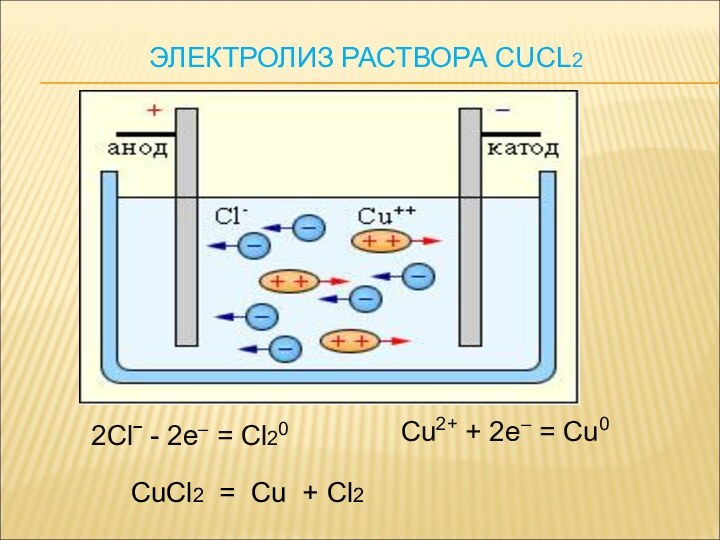
ЭЛЕКТРИЧЕСКОГО ТОКА ЧЕРЕЗ РАСТВОРЫ ИЛИ РАСПЛАВЫ ЭЛЕКТРОЛИТОВ, НАЗЫВАЮТ ЭЛЕКТРОЛИЗОМ.
При электролизе окислителем и восстановителем является электрический ток.
Процессы окисления и восстановления разделены в пространстве, они совершаются не при контакте частиц друг с другом, а при соприкосновении с электродами электрической цепи.
Катод - отрицательно- заряженный электрод.
Анод – положительно-заряженный электрод.
Катион- «+»ион, анион- «-» ион.
ПОНЯТИЯ