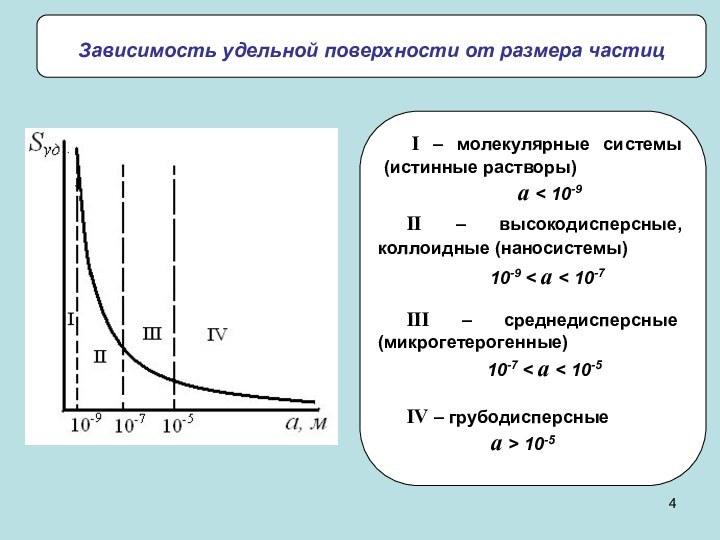
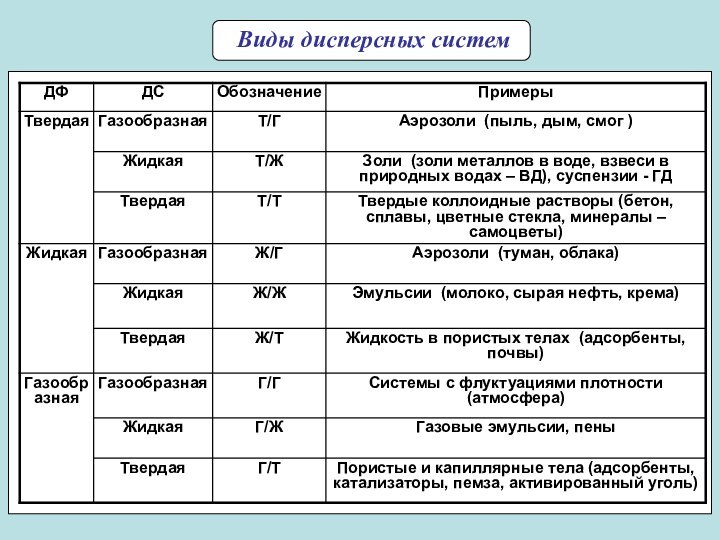
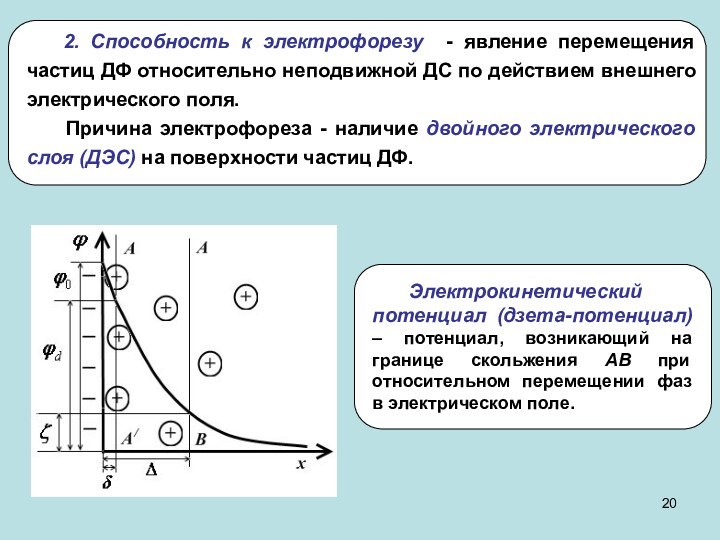
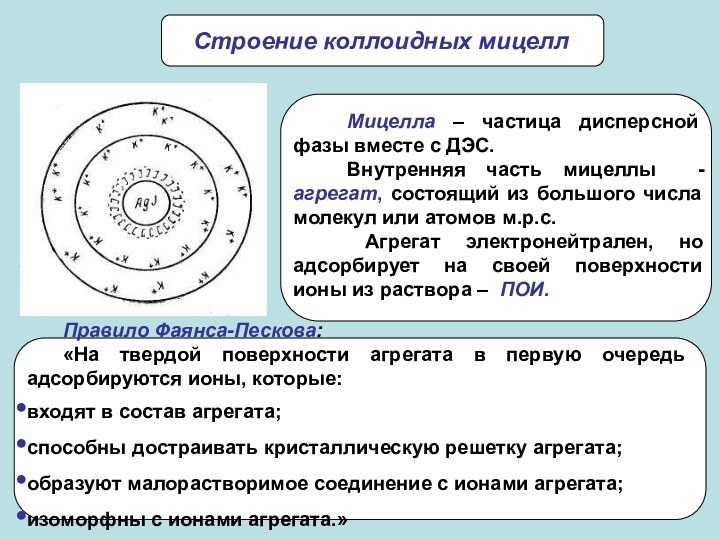
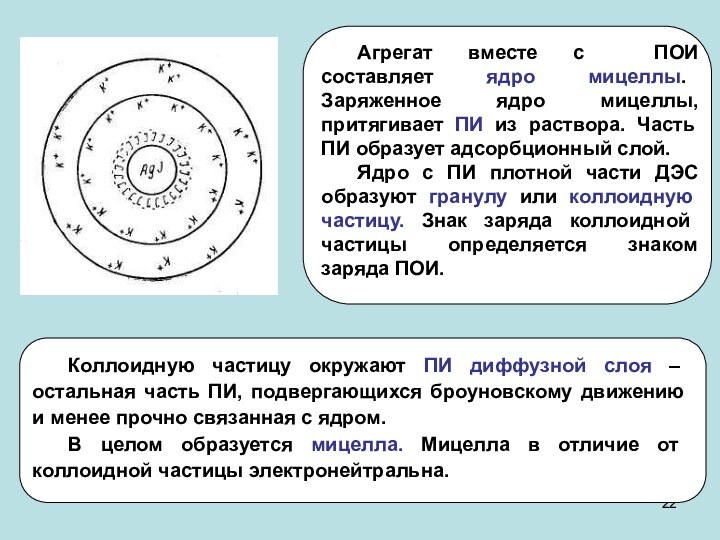
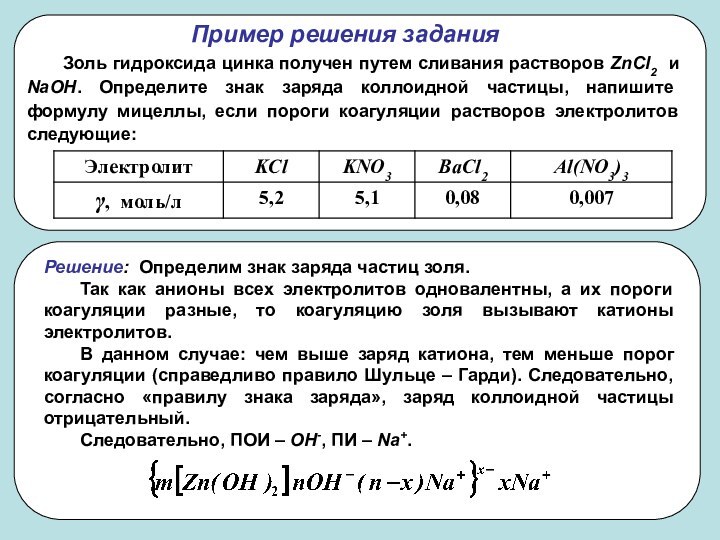
частиц (d) и длина ребра для кубических частиц (l).
Дисперсность
(D) – величина, обратная поперечному размеру частицы: D=1/a. Удельная поверхность (Sуд) – межфазная поверхность, приходящаяся на единицу объема или массы дисперсной фазы: