Слайд 2
Модель фермента нуклеозид-фосфорилазы
Слайд 3
Ферме́нты или энзи́мы (от лат. fermentum, греч. ζύμη, ἔνζυμον —
дрожжи, закваска) — обычно белковые молекулы или молекулы РНК или
их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами называются субстратами, а получающиеся вещества - продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу) Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы - повышают, ингибиторы - понижают) Белковые ферменты синтезируются на рибосомах, а РНК - в ядре.
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
Слайд 4
Классификация ферментов
По типу катализируемых реакций ферменты подразделяются

на 6 классов согласно иерархической классификации ферментов (КФ, EC —
Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Слайд 5
Соглашения о наименовании ферментов
Обычно ферменты именуют по
типу катализируемой реакции, добавляя суффикс -аза к названию субстрата
(например, лактаза — фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например, по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФаза).
Слайд 6
Функции ферментов
Ферменты — белки, являющиеся биологическими катализаторами. Ферменты

присутствуют во всех живых клетках и способствуют превращению одних
веществ (субстратов) в другие (продукты). Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах — ими катализируется около 4000 биореакций[2]. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10−10 моль/л и менее. См. также Каталитически совершенный фермент
Ферменты широко используются в народном хозяйстве — пищевой, текстильной промышленности, в фармакологии.
Слайд 7
Кинетические исследования
Простейшим описанием кинетики односубстратных ферментативных реакций
является уравнение Михаэлиса — Ментен (см. рис.). На сегодняшний
момент описано несколько механизмов действия ферментов. Например, действие многих ферментов описывается схемой механизма «пинг-понг».
Слайд 8
Кривая насыщения химической реакции, иллюстрирующая соотношение между концентрацией
субстрата [S] и скоростью реакции v
Слайд 9
Специфичность
Ферменты обычно проявляют высокую специфичность по отношению
к своим субстратам. Это достигается частичной комплементарностью формы, распределения
зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты демонстрируют высокий уровень стереоспецифичности, региоселективности и хемоселективности.
Слайд 10
Структура и механизм действия ферментов
Активность ферментов определяется
![Ферменты и их свойства Структура и механизм действия ферментов Активность ферментов определяется их трёхмерной структурой[3].Как](/img/tmb/14/1367187/0be26af228931c520f37926f2428d3ff-720x.jpg)
их трёхмерной структурой[3].
Как и все белки, ферменты синтезируются в
виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс. Третичная структура белков разрушается при нагревании или воздействии некоторых химических веществ.
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов или ионов металлов.
У некоторых ферментов есть сайты связывания малых молекул, они могут быть субстратами или продуктами метаболического пути, в который входит фермент. Они уменьшают или увеличивают активность фермента, что создает возможность для обратной связи.
Для активных центров некоторых ферментов характерно явление кооперативности.
Слайд 11
Модель индуцированного соответствия
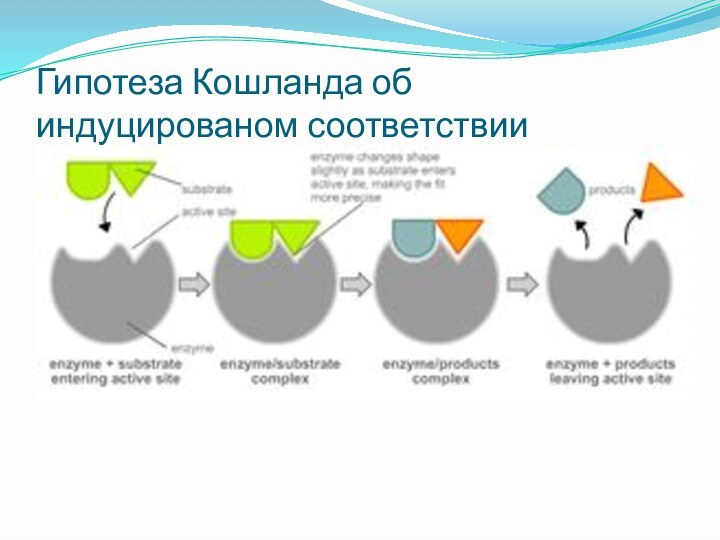
В 1958 г. Дениел Кошланд
предложил модификацию модели «ключ-замок» [5]. Ферменты, в основном, —
не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответстия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния.
Слайд 12
Модель «ключ-замок»
В 1890 г. Эмиль Фишер предположил,
что специфичность ферментов определяется точным соответствием формы фермента и
субстрата [4]. Такое предположение называется моделью «ключ-замок». Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса. Однако, хотя эта модель объясняет высокую специфичность ферментов, она не объясняет явления стабилизации переходного состояния, которое наблюдается на практике.
Слайд 13
Модификации
Многие ферменты после синтеза белковой цепи претерпевают

модификации, без которых фермент не проявляет свою активность в
полной мере. Такие модификации называются посттрансляционными модификациями (процессингом). Один из самых распространенных типов модификации — присоединение химических групп к боковым остаткам полипептидной цепи. Например, присоединение остатка фосфорной кислоты называется фосфорилированием, оно катализируется ферментом киназой. Многие ферменты эукариот гликозилированы, то есть модифицированы олигомерами углеводной природы.
Еще один распространенный тип посттранляционных модификаций — расщепление полипептидной цепи. Например, химотрипсин (протеаза, участвующая в пищеварении), получается при выщеплении полипептидного участка из химотрипсиногена. Химотрипсиноген является неактивным предшественником химотрипсина и синтезируется в поджелудочной железе. Неактивная форма транспортируется в желудок, где превращается в химотрипсин. Такой механизм необходим для того, чтобы избежать расщепления поджелудочной железы и других тканей до поступления фермента в желудок. Неактивный предшественник фермента называют также «зимогеном».
Слайд 14
Гипотеза Кошланда об индуцированом соответствии
Слайд 15
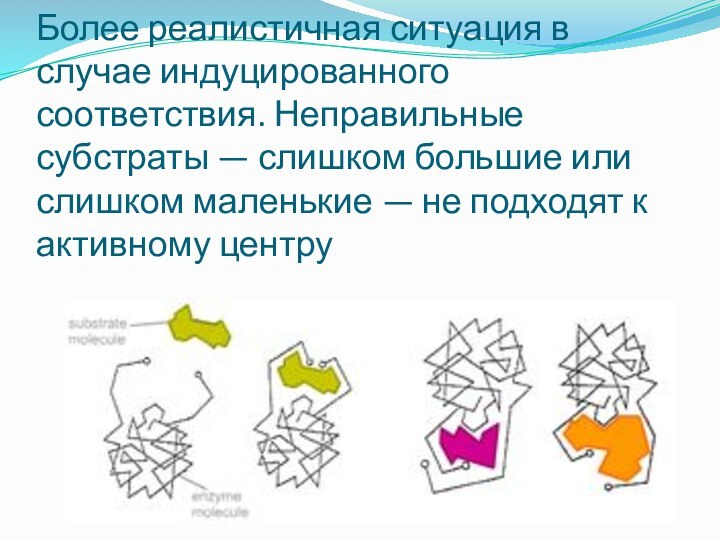
Более реалистичная ситуация в случае индуцированного соответствия. Неправильные
субстраты — слишком большие или слишком маленькие — не подходят к
активному центру
Слайд 16
Кофакторы ферментов
Некоторые ферменты выполняют каталитическую функцию сами
по себе, безо всяких дополнительных компонентов. Однако есть ферменты,
которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большинство кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.






![Ферменты и их свойства Кривая насыщения химической реакции, иллюстрирующая соотношение между концентрацией субстрата [S] и скоростью реакции v](/img/tmb/14/1367187/286cedb9ed57ad7818520133a4073b55-720x.jpg)

![Ферменты и их свойства Структура и механизм действия ферментов Активность ферментов определяется их трёхмерной структурой[3].Как и](/img/tmb/14/1367187/0be26af228931c520f37926f2428d3ff-720x.jpg)