t, OH
R-Cl + H2O ↔
R-OH + HClГидролиз сложных эфиров:
∕∕ H , t ∕∕
R1-C + H2O ↔ R2-OH + R1- C
O-R2 OH
О
О
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть





















О
О
│
│
│
│
│
│
│
│
∕∕
∕∕
∕∕
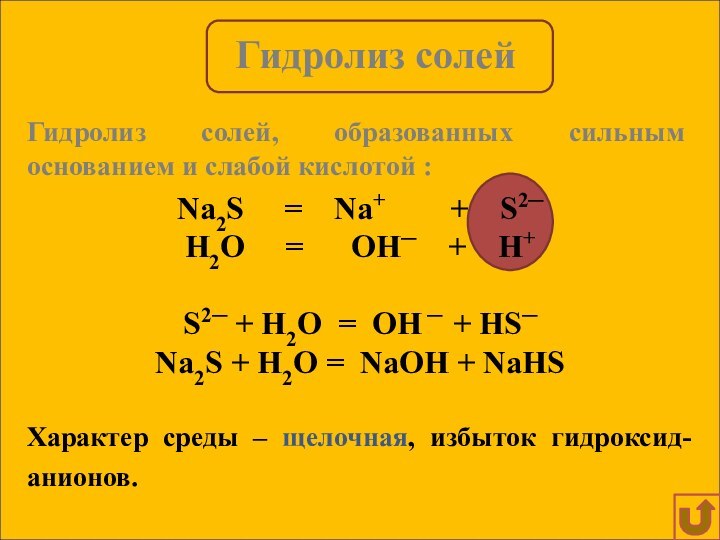
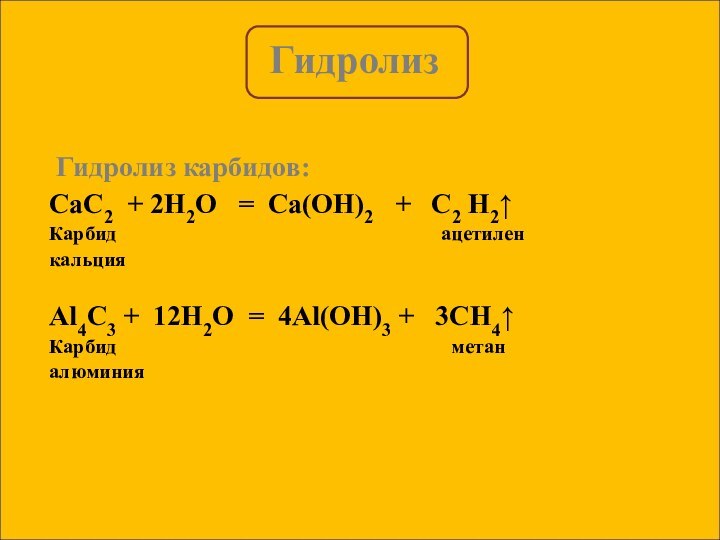
Гидролиз солей, образованных сильным основанием и слабой кислотой :
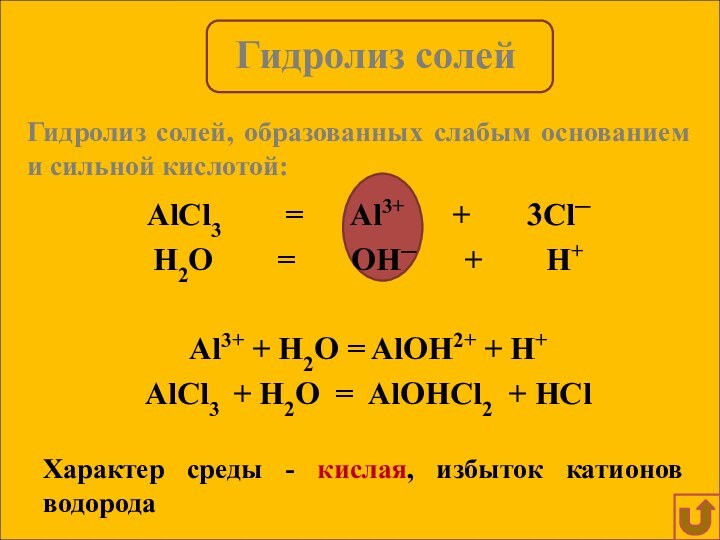
Гидролиз солей, образованных слабым основанием и сильной кислотой:
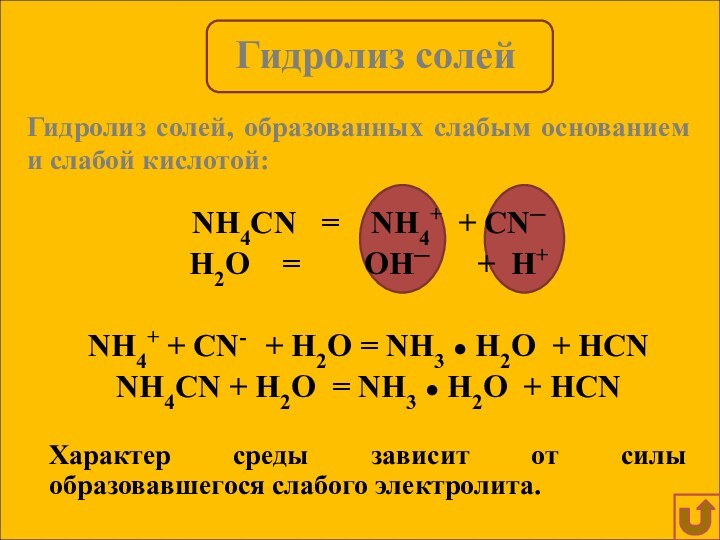
Гидролиз солей, образованных слабым основанием и слабой кислотой:
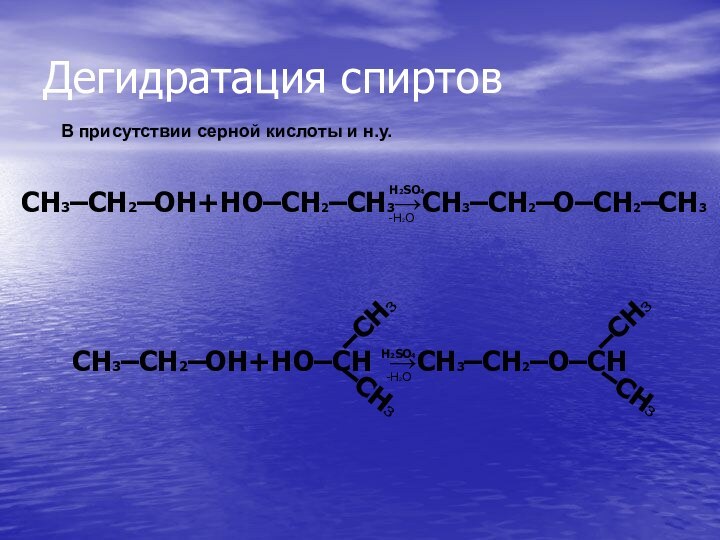
CH2=CH2 + H2O → CH3–CH2–OH
CH3–CH2–OH→ CH2=CH2
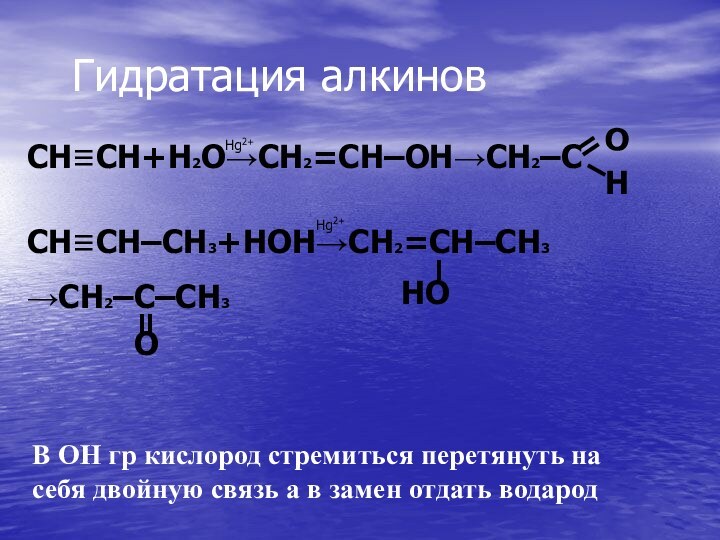
Hg2+
Hg2+
CH≡CH+H2O→CH2=CH–OH→CH2–C