- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Химические свойства кислот
Содержание
- 2. Цели урока:Познакомиться с химическими свойствами кислот.Научиться использовать
- 3. Назовите кислоты: HCl
- 4. Кислотами называют сложные вещества,
- 5. Ответь на вопросы: На какие группы делятся кислоты:по составу? по основности?по силе?
- 6. Классификация кислот по составу кислотного остаткакислотыБескислородныеHF, H
- 7. Классификация кислот по количеству атомов водородаОдноосновныеHF, H
- 8. Классификация кислот по силе кислотыСильные: HNO3,
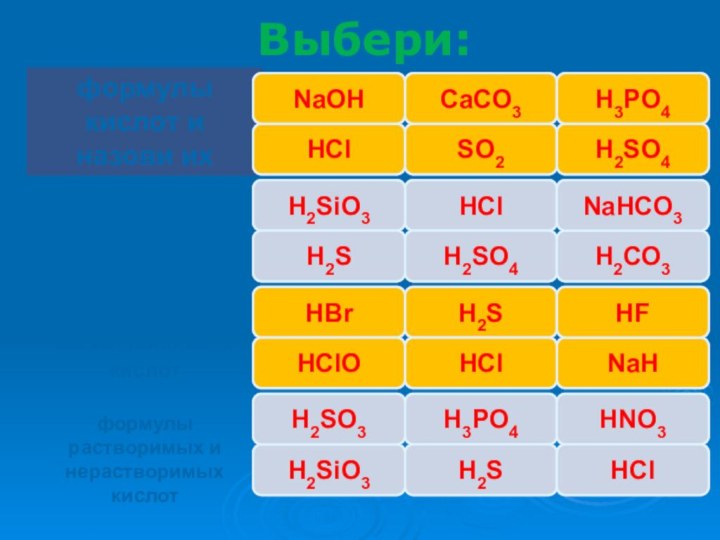
- 9. Выбери:правильноошибкаошибкаошибкаправильноправильноNaОHHClCaCO3SO2H3PO4H2SO4правильноошибкаошибкаправильноправильноошибкаHClH2SiO3H2SH2SO4H2СО3NaHCO3правильноошибкаошибкаправильноправильноошибкаHBrH2SHClONaHHClHFрастворимане растворимарастворимарастворимарастворимарастворимаH2SiO3H2SO3H3PO4H2SHNO3HСl
- 10. Кислоты в природе Кислоты постоянно присутствуют
- 11. Кислоты в животном мире Если вы
- 12. Кислоты в растительном мире Многие
- 13. Кислоты в нашей жизни
- 14. Нахождение кислот в природеЛимонная кислота содержится в
- 15. Соляная кислота, находящаяся в желудке, помогает переваривать пищу.Молочная кислота образуется в мышцах при физической нагрузке.
- 16. Физические свойства кислотЖидкости, неограниченно смешивающиеся
- 17. Разбавление серной кислоты водойС давних пор существует
- 18. Правила техники безопасности при работе с кислотами
- 19. Химические свойства кислот
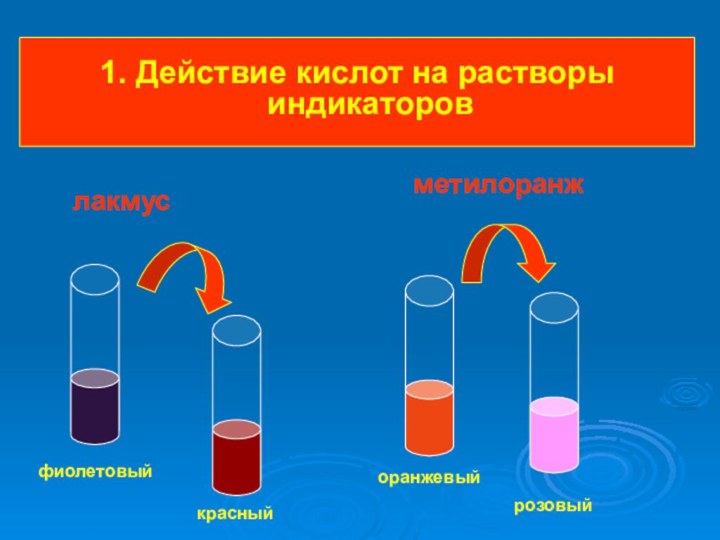
- 20. 1. Действие кислот на растворы индикаторов фиолетовыйкрасныйоранжевыйрозовый лакмус метилоранж
- 21. Действие на индикаторы
- 22. 2. Взаимодействие кислот с металламиZn +
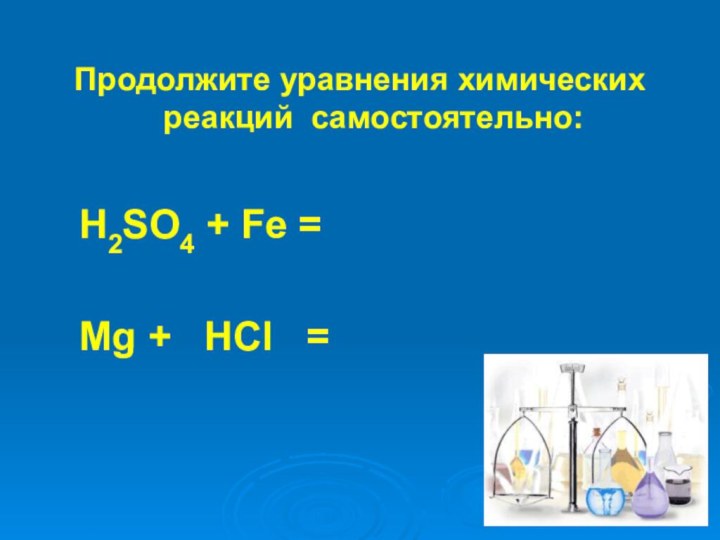
- 23. Продолжите уравнения химических реакций самостоятельно: H2SO4 + Fe = Mg + HCl =
- 24. ПроверимH2SO4 + Fe = FeSO4 + H2 Mg + 2HCl = MgCl2 + H2
- 25. Все ли металлы реагируют с кислотами ?
- 26. Ряд активности металловLi K Ba Sr Ca
- 27. основный оксид + кислота = соль +
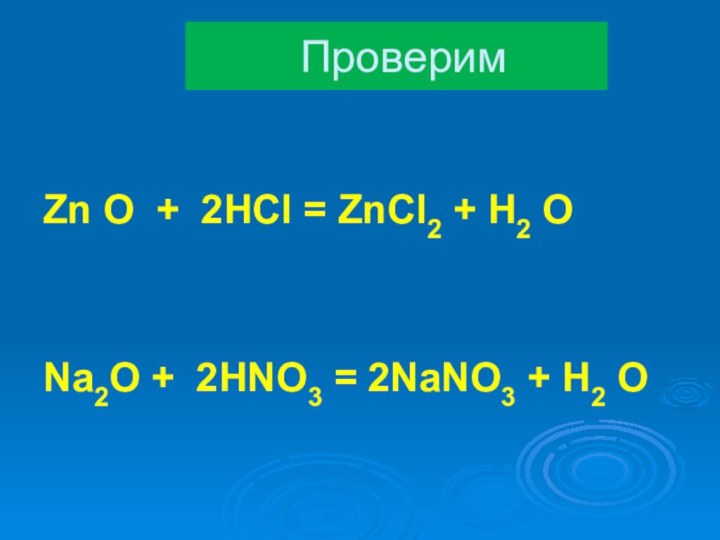
- 28. Продолжите уравнения химических реакций самостоятельно:Zn O + HCl =Na2O + HNO3 =
- 29. Zn O + 2HCl = ZnCl2 + H2 ONa2O + 2HNO3 = 2NaNO3 + H2 OПроверим
- 30. NaOH +HCI =
- 31. Продолжите уравнения химических реакций самостоятельно: KOH + H2SO4 = Cu(OH)2+ HNO3 =
- 32. 2KOH + H2SO4 = K2SO4 + 2H2O Cu(OH)2+ 2HNO3 = Cu(NO3)2 + 2H2OПроверим
- 33. 5. Взаимодействие кислот с растворами
- 34. Продолжите уравнения химических реакций самостоятельно: HCl + AgNO3 = HNO3 + Na2SiO3 =
- 35. HCl + AgNO3 = AgCl + HNO3 2HNO3 + Na2SiO3 = 2NaNO3 + H2SiO3 Проверим
- 36. H2CO3 = H2O + CO2H2SO3 = H2O
- 37. КИСЛОТЫ
- 38. КИСЛОТЫ ПРИМЕНЯЮТСЯ В КУЛИНАРИИ .Уксусная и лимонная кислоты.
- 39. Роль кислот в создании почвыСамая значительная функция
- 40. SO2+H2O=H2SO3 ОБРАЗОВАНИЕ КИСЛОТНЫХ ДОЖДЕЙ В ПРИРОДЕ.
- 41. Интересный опыт:Что произойдет, если к сахару добавить концентрированную серную кислоту?
- 42. Концентрированная серная кислота обугливает органические вещества.
- 43. Проверьте свои знания С какими из перечисленных
- 44. Скачать презентацию
- 45. Похожие презентации




































Слайд 2
Цели урока:
Познакомиться с химическими свойствами кислот.
Научиться использовать на
уроках химии электрохимический ряд напряжения металлов и таблицу растворимости.
Слайд 3
Назовите кислоты:
HCl
H2SO4 H3PO4
1. Кислоты
– это простые или сложные вещества?2. Что общего в составе кислот?
3. Сформулируйте определение кислоты.
Ответь на вопросы:
Слайд 4 Кислотами называют сложные вещества, молекулы
которых
состоят из атомов водорода, способных замещаться на
атомы металлов, и кислотных остатков.
Слайд 6
Классификация кислот по составу кислотного остатка
кислоты
Бескислородные
HF, H Cl,
H Br, HI
H2S
Кислородсодержащие
HNO3, HNO2
H2SO4 , H2SO3
H2CO3, H2SiO3
H3PO4
Слайд 7
Классификация кислот по количеству атомов водорода
Одноосновные
HF, H Cl,
H Br, HI
HNO3, HNO2
кислоты
Двухосновные
H2SO4 , H2SO3
H2CO3 , H2SiO3
H2S
многоосновные
H3PO4
Слайд 8
Классификация кислот по силе
кислоты
Сильные: HNO3,
H2SO4,
HClO4,
HI, HBr, HCl
Слабые: H2S, H2SO3, H2CO3
Средней
силы:H3PO4, HCOOH
Слайд 9
Выбери:
правильно
ошибка
ошибка
ошибка
правильно
правильно
NaОH
HCl
CaCO3
SO2
H3PO4
H2SO4
правильно
ошибка
ошибка
правильно
правильно
ошибка
HCl
H2SiO3
H2S
H2SO4
H2СО3
NaHCO3
правильно
ошибка
ошибка
правильно
правильно
ошибка
HBr
H2S
HClO
NaH
HCl
HF
растворима
не растворима
растворима
растворима
растворима
растворима
H2SiO3
H2SO3
H3PO4
H2S
HNO3
HСl
Слайд 10
Кислоты в природе
Кислоты постоянно присутствуют вокруг
нас. Например, дождевая вода на первый взгляд кажется чистой.
На самом деле в ней присутствует немало других веществ. За счет растворения углекислого газа из атмосферы она является раствором угольной кислоты. После летней грозы в дождевой воде оказывается еще и азотная кислота. Извержения вулканов и сгорание топлива способствуют появлению в дождевой и снеговой воде серной кислоты.
Слайд 11
Кислоты в животном мире
Если вы присядете
вблизи муравейника, то надолго запомните жгучие укусы его обитателей.
Муравей впрыскивает в ранку от укусу яд, содержащий муравьиную кислоту. Муравьиной кислотой обусловлено жжение крапивы, ее выделяют некоторые гусеницы.Тропический паук стреляет во врагов струйкой жидкости, содержащей 84% уксусной кислоты.
Плоские тысяченожки используют пары синильной кислоты.
Некоторые жуки выстреливают струйкой разбавленной серной кислоты.
Слайд 12
Кислоты в растительном мире
Многие растения
содержат кислоты и используют их как
«Химическое
оружие» Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться.
Однако лоси жуют мухоморы и не погибают от этого. Скорее – наоборот: мухоморами они лечат какие-то свои «хвори».
Ботаникам известно более 800 видов растений, вырабатывающих синильную кислоту.
Многие растения выделяют кислоты, угнетая ими другие виды растений.
В волосках крапивы содержится жгучая
муравьиная кислота
Слайд 14
Нахождение кислот в природе
Лимонная кислота содержится в лимонах,
яблочная кислота - в яблоках, щавелевая кислота - в
листьях щавеля.В пчелином яде, в волосках крапивы, в иголках сосны и ели содержится муравьиная кислота. Муравьи, защищаясь от врагов, разбрызгивают капельки муравьиной кислоты.
При скисании виноградного сока и молока, при квашении капусты образуется молочная кислота.
Слайд 15
Соляная кислота, находящаяся в желудке, помогает переваривать пищу.
Молочная
кислота образуется в мышцах при физической нагрузке.
Слайд 16
Физические свойства кислот
Жидкости, неограниченно смешивающиеся с
водой:
H2SO4, HNO3, HCI .
Твёрдые вещества,
растворимые в воде:H3PO4, HPO3.
Нерастворимая в воде H2SiO3 .
Летучие кислоты HCI, H2S, HNO3
имеют запах.
Многие кислоты токсичны и
вызывают ожоги кожи.
Слайд 17
Разбавление серной кислоты водой
С давних пор существует строгое
правило: «Сначала вода, потом кислота, иначе случится большая беда!»
Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду.
Слайд 18
Правила техники безопасности при работе с кислотами
При растворении серной кислоты нужно вливать ее
тонкой струей в воду и перемешивать !!! H2SO4
Н2О
С растворами кислот надо обращаться
осторожно, при попадании на кожу или одежду данных веществ - промыть большим количеством воды и обработать разбавленным раствором соды.
Слайд 20
1. Действие кислот на растворы индикаторов
фиолетовый
красный
оранжевый
розовый
лакмус
метилоранж
Слайд 22
2. Взаимодействие кислот с металлами
Zn + 2
HCI = ZnCI2 + H2
металл + кислота =
соль + водород Zn
HCl
H 2
Слайд 26
Ряд активности металлов
Li K Ba Sr Ca Na
Mg Al Mn Zn Cr Fe Cd Co Ni
Sn Pb(H2)
Cu Hg Ag Pt Au
Схема:
Cu +
HCL
≠
Слайд 27
основный оксид + кислота = соль + вода
CuO
+ H2SO4 = CuSO4 + H2O
3. Взаимодействие кислот с
основными оксидамиCu O + H2SO4
Cu SO 4
H2O
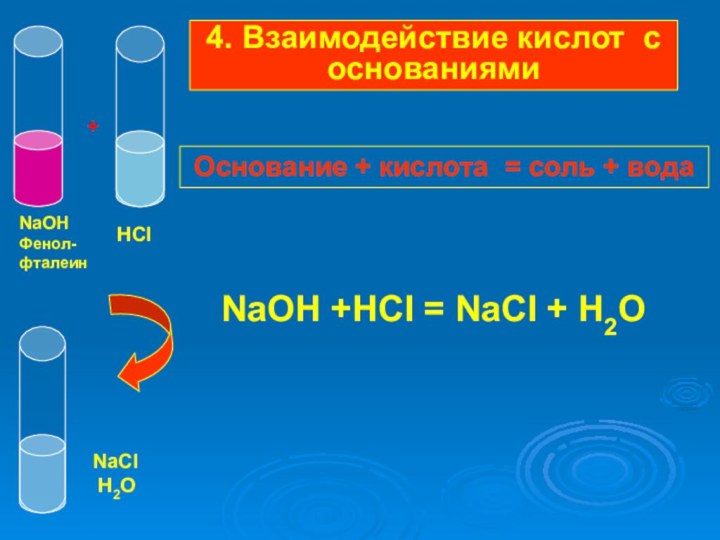
Слайд 30
NaOH +HCI = NaCI
+ H2O
NaOH
Фенол-
фталеин
HCl
+
NaCl
H2O
4. Взаимодействие кислот с основаниями
Основание
+ кислота = соль + вода
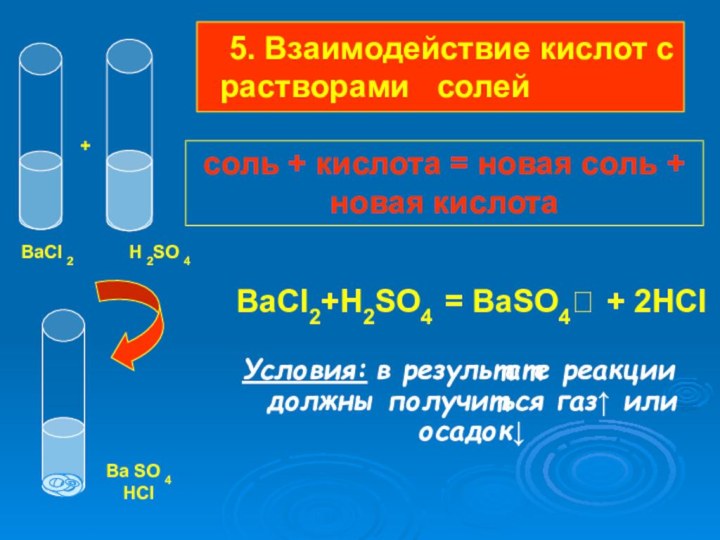
Слайд 33
5. Взаимодействие кислот с растворами солей
BaCI2+H2SO4 = BaSO4 + 2HCI
Условия: в результате реакции
должны получиться газ↑ или осадок↓ +
BaCI 2
H 2SO 4
Ba SO 4
HCI
соль + кислота = новая соль + новая кислота
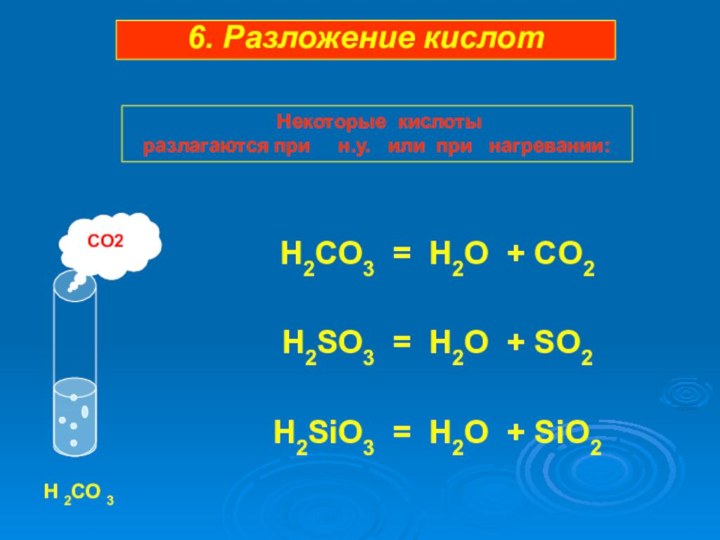
Слайд 36
H2CO3 = H2O + CO2
H2SO3 = H2O +
SO2
H2SiO3 = H2O + SiO2
CO2
H 2CO 3
6. Разложение кислот
Некоторые кислотыразлагаются при н.у. или при нагревании:
Слайд 39
Роль кислот в создании почвы
Самая значительная функция кислот
в природе состоит в разрушении горных пород и создании
почвы. Ведь было время, когда вся земная суша представляла собой голые камни. Сотни миллионов лет потребовалось на то, чтобы солнце, ветер и слабый раствор кислот – дождевая вода – разрушили камни на песчинки. Появившиеся затем растения тут же подключились к процессу разрушения горных пород и созданию почвы.
Слайд 43
Проверьте свои знания
С какими из перечисленных веществ
реагирует хлоридная кислота:
Ba(OH)2, AgNO3, Na Cl, Hg, Na2O, Fe,
ZnO, CO2?Составьте уравнения возможных химических реакций.





























