– это путь самый благородный; путь подражания – это
путь самый легкий ипуть опыта – это путь самый горький»
Конфуций
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




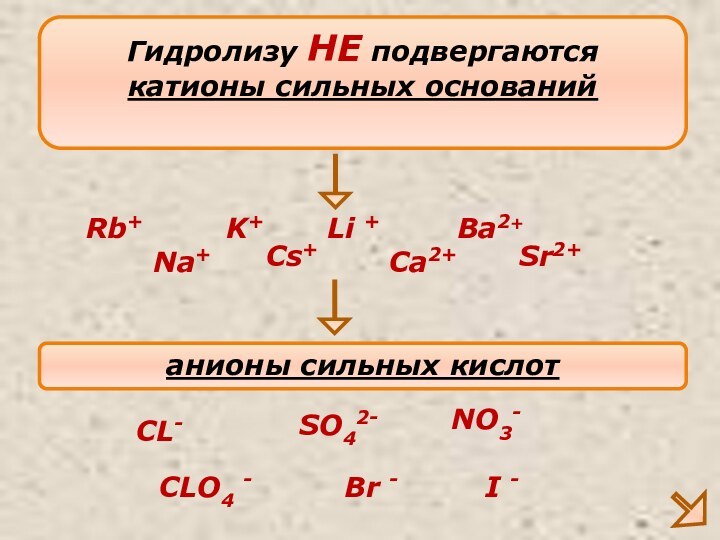
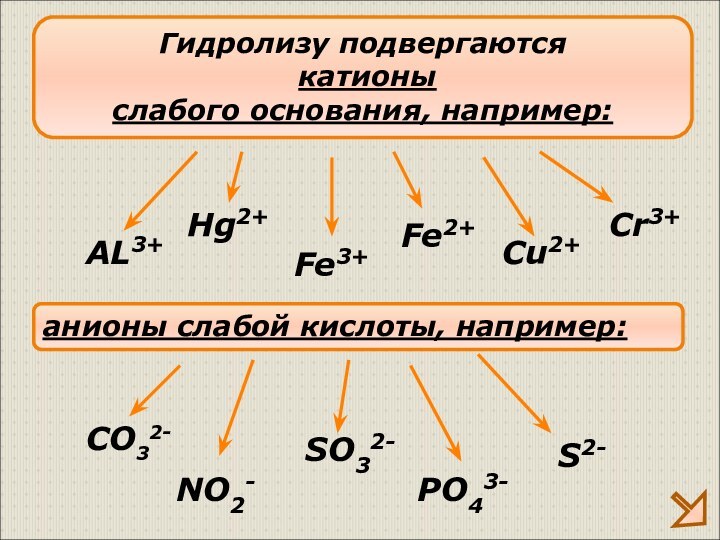


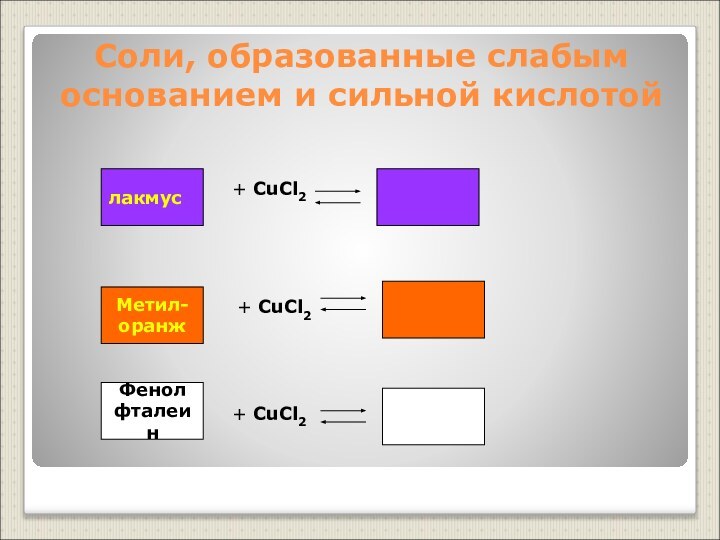
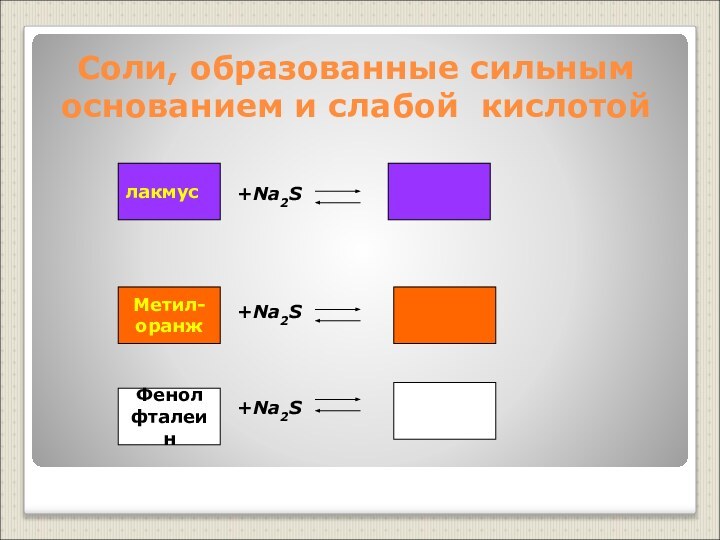
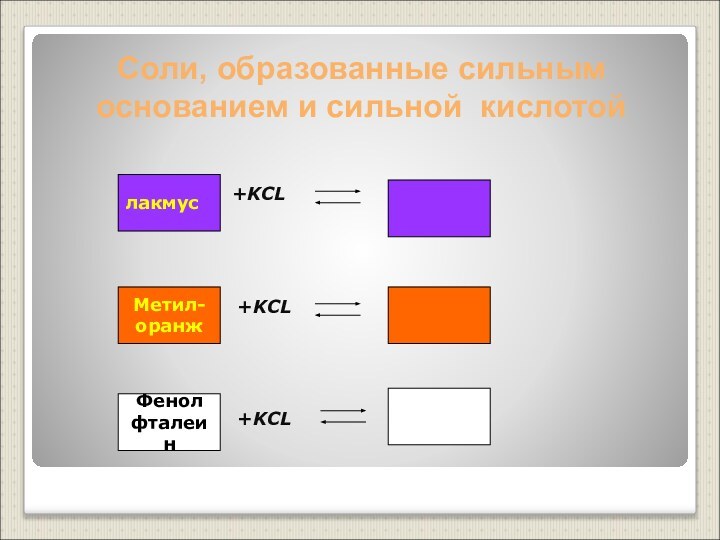
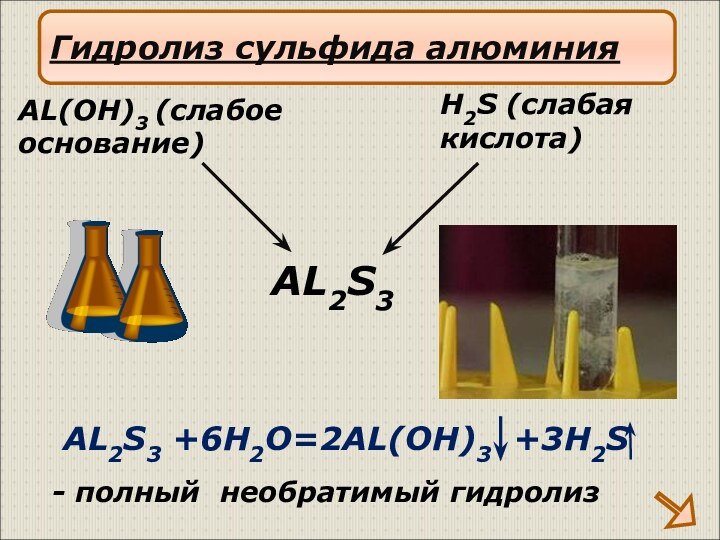
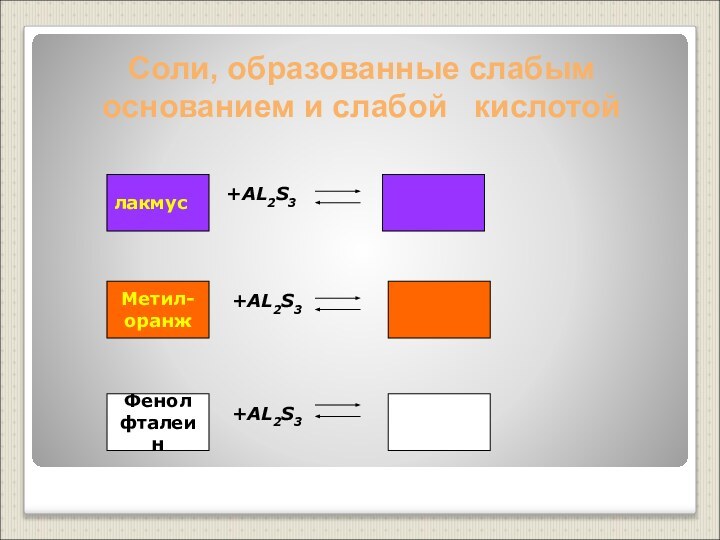







Слабые основания – нерастворимые основания, слабые электролиты (Cu(OH)2, Al(OH)3 и другие)
Сильные кислоты – кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, HBr, HI, HClO4 и другие)
Слабые кислота – кислоты, являющиеся слабыми электролитами (H2CO3, H2SO3, H2S, H2SiO3, H3PO4 и др)
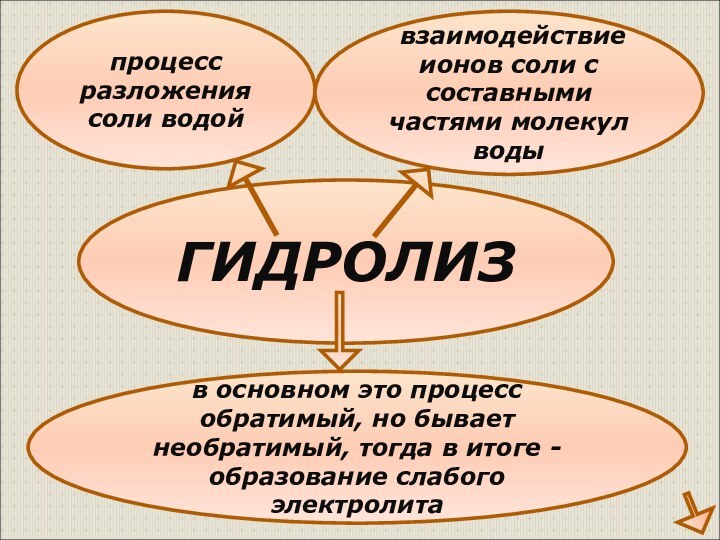
Соль образована
слабым основанием и слабой кислотой
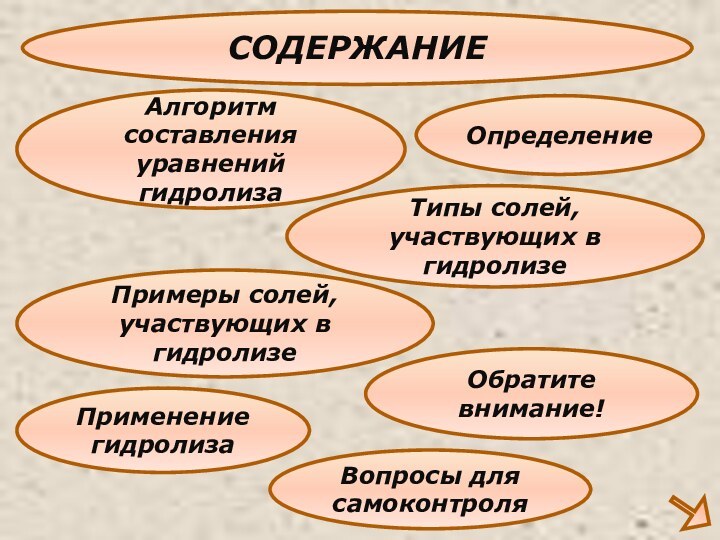
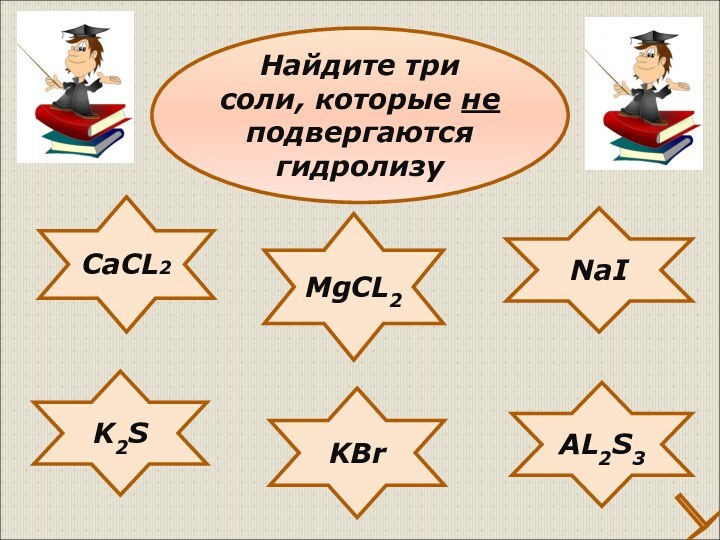
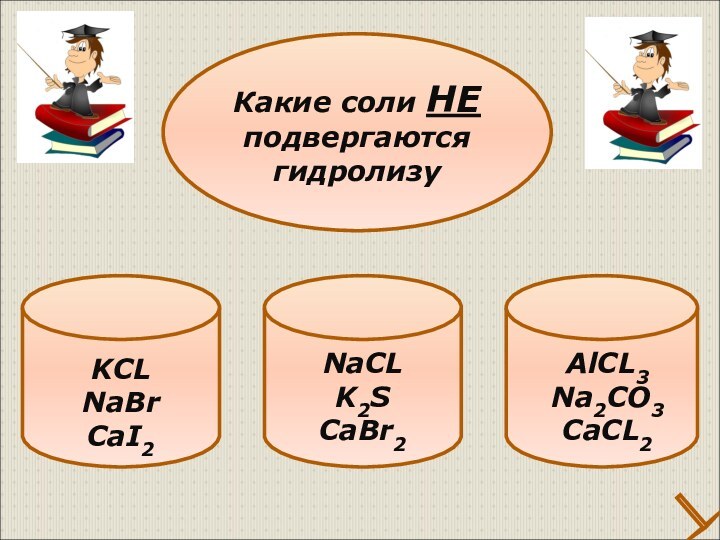
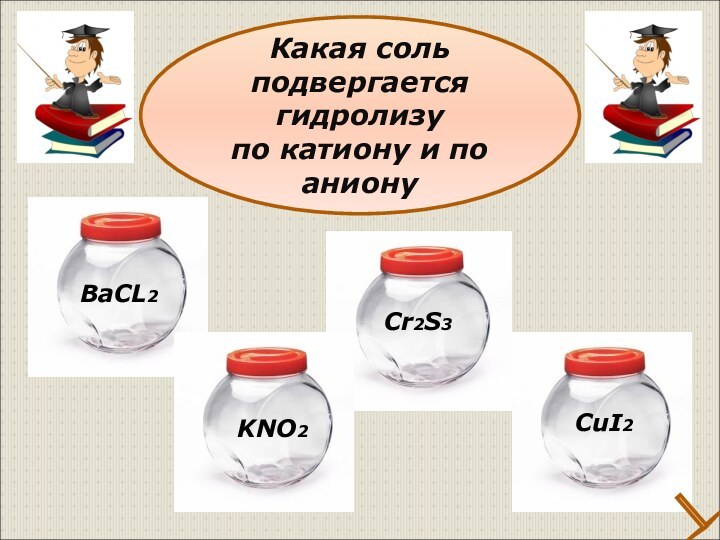
Классификация солей
участвующих в гидролизе:
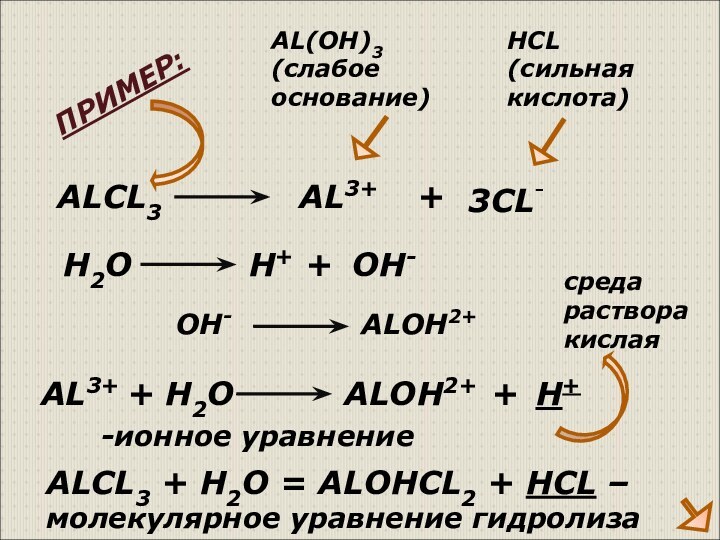
ПРИМЕР:
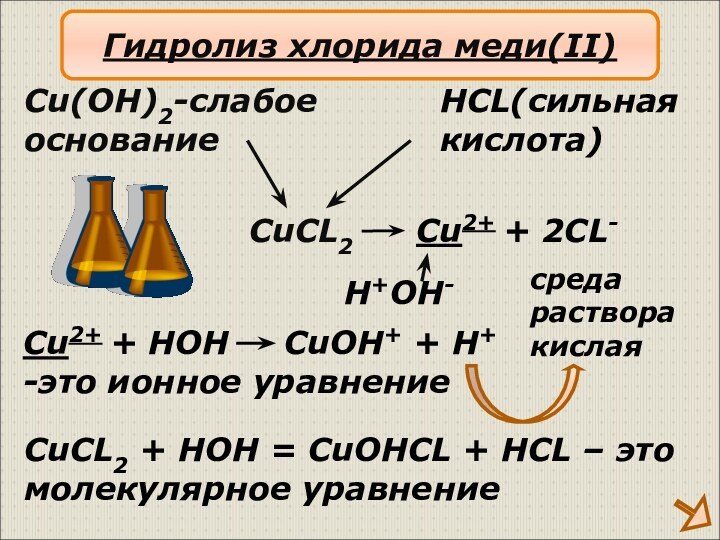
среда
раствора
кислая
H2O
+
OH-
ALOH2+
Записать диссоциацию соли и подчеркнуть ион слабого электролита
Записать уравнение взаимодействия иона слабого электролита с водой
Определить среду раствора соли
Записать молекулярное уравнение
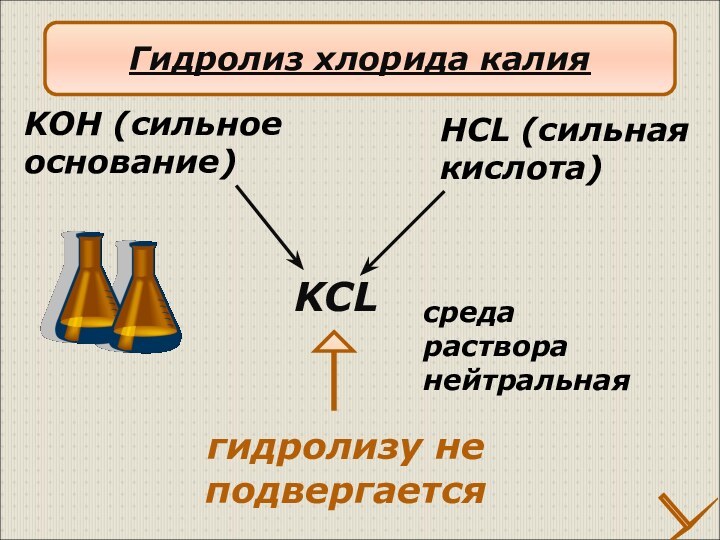
Гидролиз хлорида меди(II)
среда
раствора
кислая
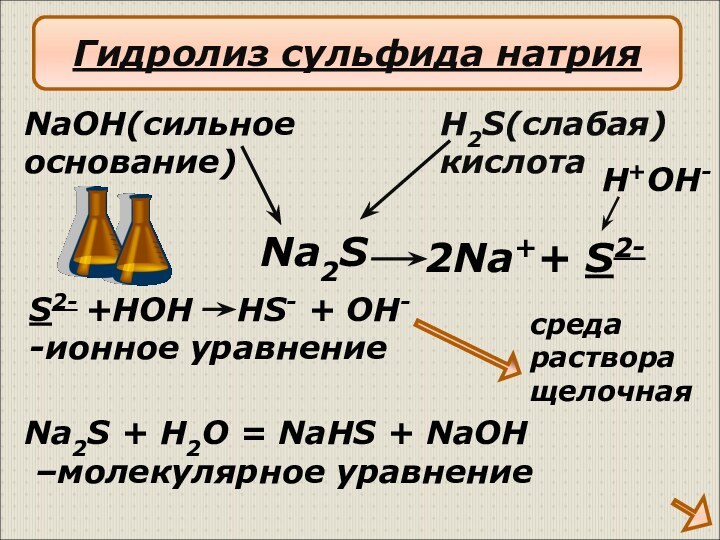
Na2S
H+OH-
среда
раствора
щелочная
Гидролиз сульфида натрия
Загрязнения представляют собой смесь твердых частиц (пыли, сажи, соли, жировых, а также потовых пленок, прилипших к поверхности тканей и других предметов).
Чтобы удалить загрязнения необходимо:
отделить загрязнение от очищаемой поверхности;
перевести грязевые частицы в моющий раствор;
удержать их в моющем растворе и устранить возможность повторного осаждения на очищаемую поверхность.
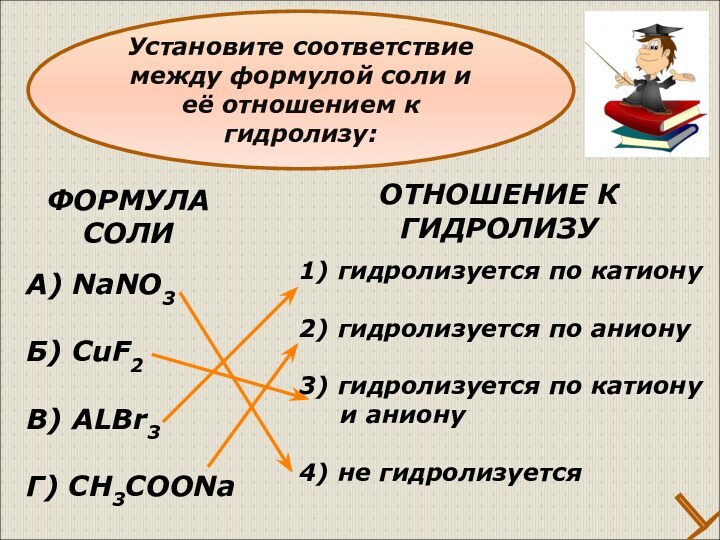
ОТНОШЕНИЕ К
ГИДРОЛИЗУ
Установите соответствие между формулой соли и её отношением к гидролизу:
В растворе сульфата меди(ll) кислая среда
да
нет
да
нет
да
да
Выберите истинные и ложные утверждения
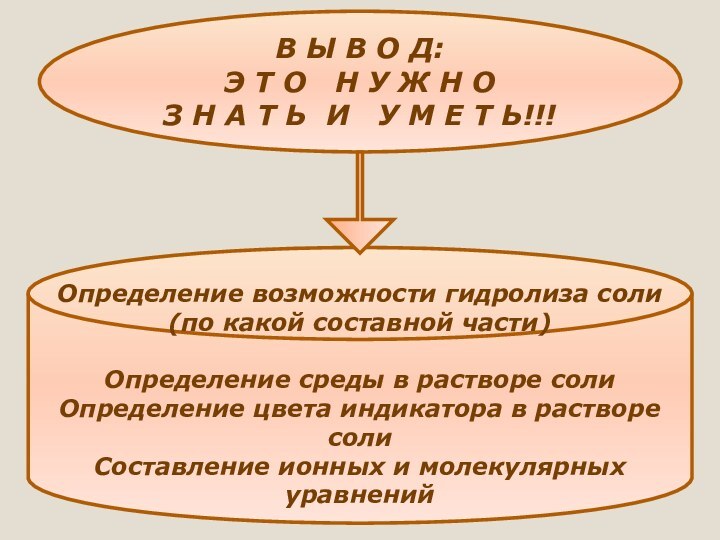
Определение возможности гидролиза соли (по какой составной части)
Определение среды в растворе соли
Определение цвета индикатора в растворе соли
Составление ионных и молекулярных уравнений