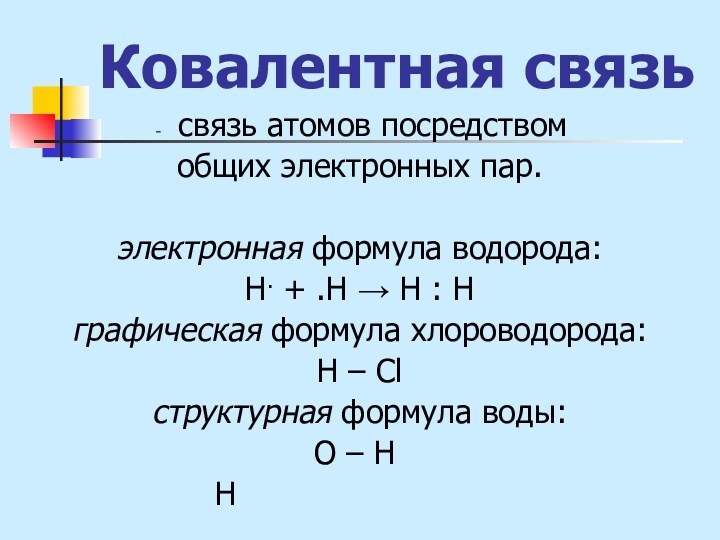
водорода:
Н. + .Н → Н : Н
графическая формула хлороводорода:
Н
– Clструктурная формула воды:
О – Н
Н
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть






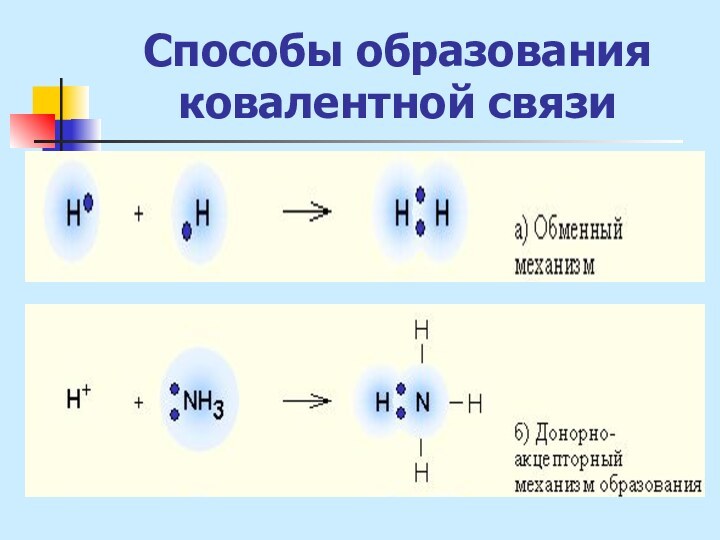


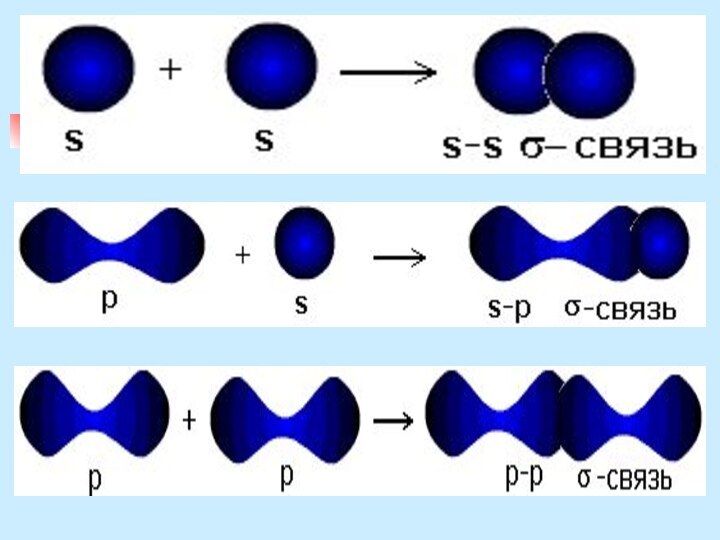

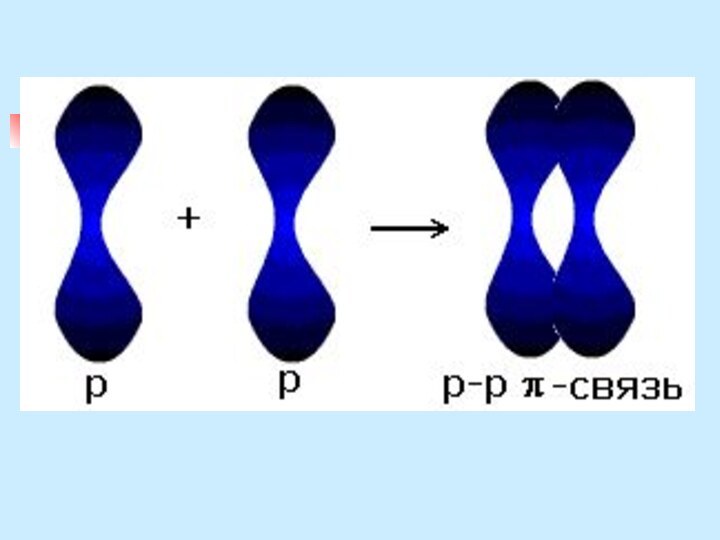
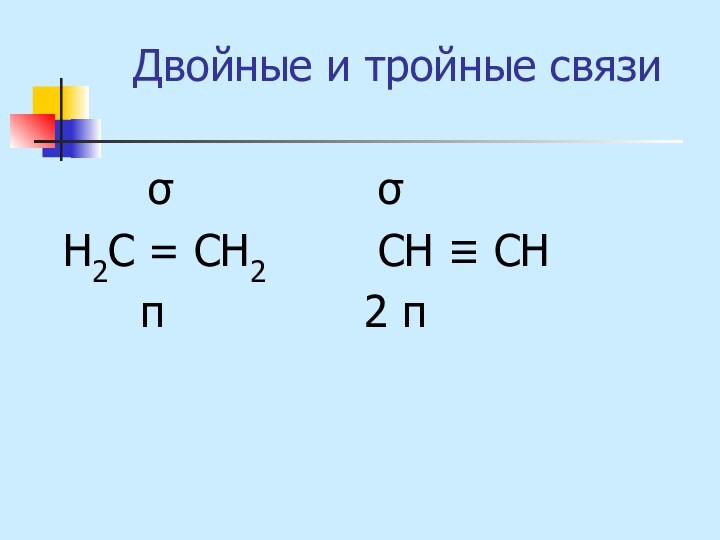


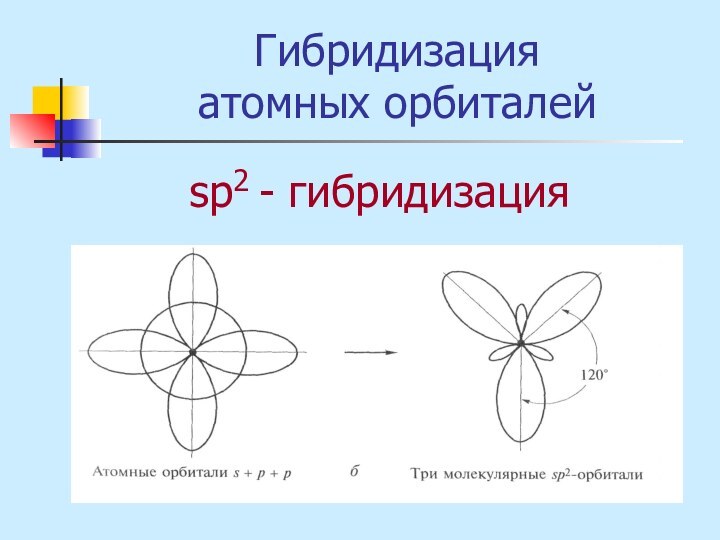
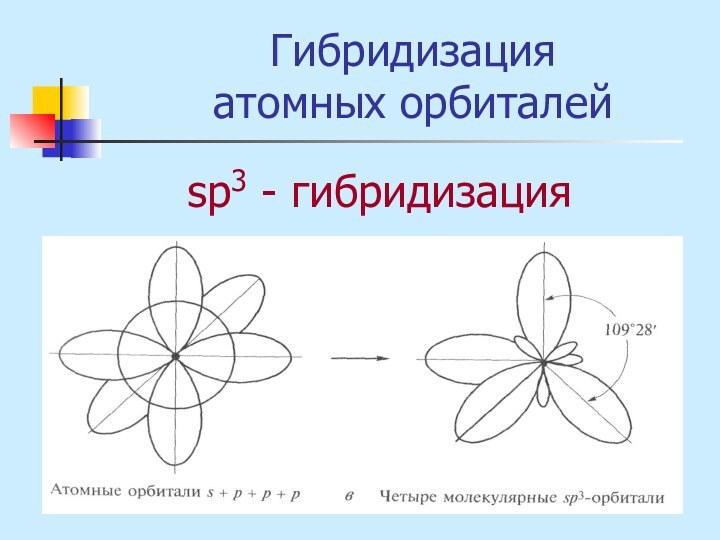




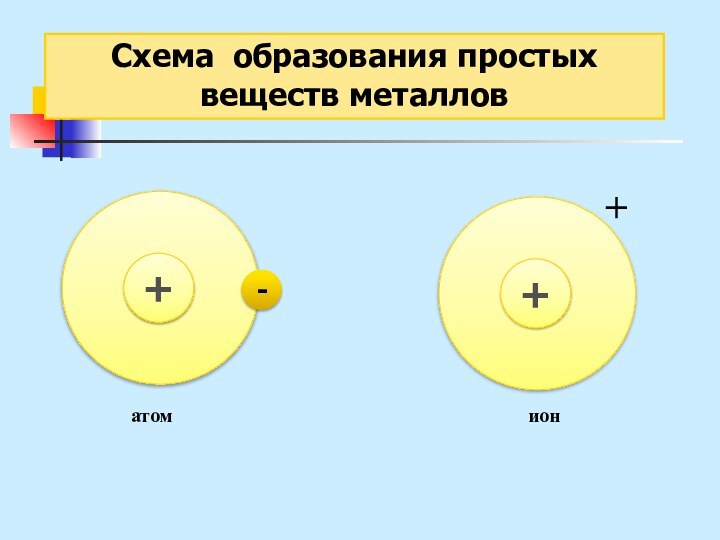
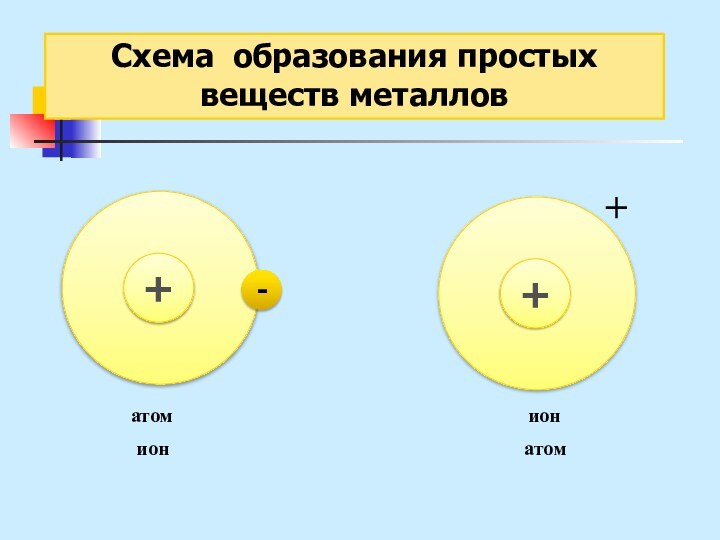
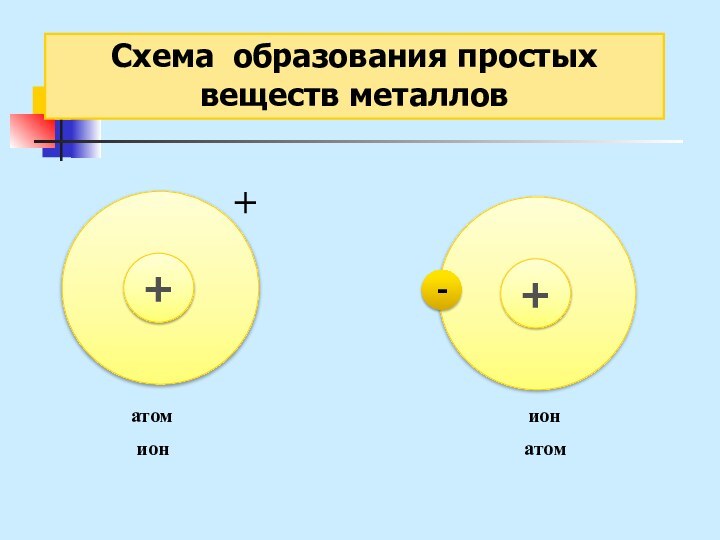





неМе + неМе (сложное вещество)
Э.О. < Э.О. – ковалентная полярная связь
Ме (простое вещество металл) – металлическая химическая связь