- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Свойства кислорода. Оксиды
Содержание
- 2. Девиз урока: «Кислород – это вещество, вокруг которого вращаетсяземная химия».
- 3. Тема: Свойства кислорода.
- 4. Задачи: Образовательные: познакомить учащихся с историей открытия
- 7. Физические свойства кислородаИстория открытие кислородаКислород, общая характеристикаОкислениеХимические свойства кислородаПолучение кислорода.кислород
- 13. Способы получения кислорода в лаборатории1. Уравнения реакции
- 14. Способы получения кислорода в промышленности1. Электролиз воды
- 15. Физические свойства кислорода Кислород – газ, состоящий
- 17. Взаимодействие с серой
- 18. 2. Взаимодействие с фосфором
- 19. ВЗАИМОДЕЙСТВИЕ ПРОСТЫХ И СЛОЖНЫХ ВЕЩЕСТВ
- 20. SO2- оксид серы(IV)P2O5- оксид фосфора(V)Fe O- оксид
- 21. 1.S+O2=SO2
- 22. ТЕСТ. 1. Самый распространенный х.э.:
- 23. 9. В лаборатории кислород получают:
- 24. 3. Впервые кислород получил:
- 25. 5. Валентность кислорода в соединениях:
- 26. 7. Относительная молекулярная масса кислорода:
- 27. Вопросы для закрепления. Из перечисленных
- 29. Вопросы к кроссворду:
- 30. Ответить на вопросы.Назовите
- 31. Скачать презентацию
- 32. Похожие презентации
Девиз урока: «Кислород – это вещество, вокруг которого вращаетсяземная химия».






























Слайд 3 Тема: Свойства кислорода.
Оксиды.
Цель: сформулировать
у учащихся представление о кислороде, изучить его свойства, дать общее понятие об оксидах, окислении, рассмотреть практическую значимость и применение.
Слайд 4
Задачи:
Образовательные: познакомить учащихся с историей открытия кислорода,
именами ученых,
связанных с этим открытием,
общей характеристикой элемента
и простого вещества, изучить физические и химические свойства кислорода,
дать понятие об оксидах и окислении.
Познакомить учащихся с основными способами получения кислорода
в лаборатории и промышленности,
дать первоначальное понятие о катализаторе,
познакомить с нахождением кислорода в природе и его применением.
Слайд 5
Развивающие:
развитие навыков самостоятельной деятельности
через работу с учебником,
дополнительной литературой,
развитие познавательного интереса,
развитие логического мышления,
расширение кругозора.
Слайд 6
Воспитательные:
формирование основных мировоззренческих идеи
материальности мира,
воспитание настойчивости в овладении знаний,
самостоятельности, дисциплины, аккуратности,
воспитание любви к окружающей среде,
предмету.
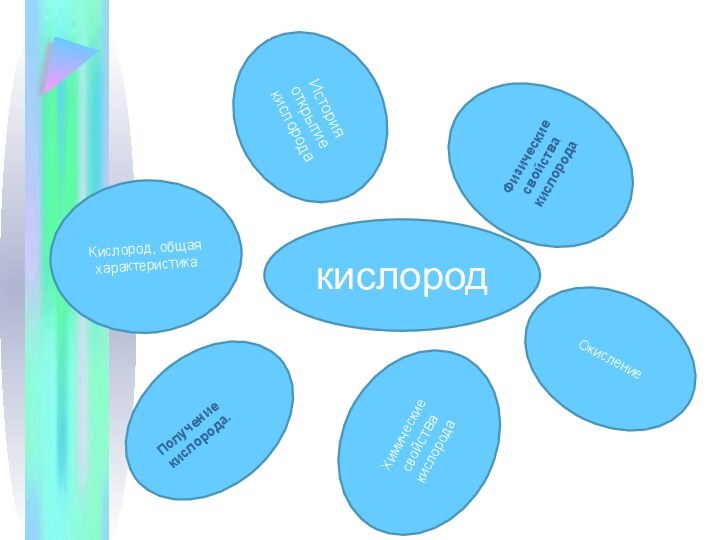
Слайд 7
Физические свойства кислорода
История открытие кислорода
Кислород, общая характеристика
Окисление
Химические свойства
кислорода
Получение кислорода.
кислород
Слайд 12
Нахождение
в природе.
Кислород – самый распространённый
химический элемент в земной
коре.Воздух содержит 0,209 объёмных долей
или 20,9% кислорода,
что составляет
приблизительно 1/5 по объёму.
Слайд 13
Способы получения кислорода в лаборатории
1. Уравнения реакции получения
кислорода разложением перманганата калия при нагревании
разложением некоторых кислород
содержащих веществ2H2O2 - 2Н2О + О2
пероксид вода кислород
водорода
2KClO3 - 2KCl+ 3O2
хлорат хлорид кислород
калия калия
Слайд 15
Физические свойства кислорода
Кислород – газ, состоящий из
двухатомных молекул кислорода.
Не имеет запаха и цвета.
Кислород
немного тяжелее воздуха: 1л кислорода при нормальных условиях весит 1,43г., 1л. воздуха – 1,29г.
Слайд 16
Химические свойства
.
Горение –
это химическая реакция, при которой происходит
окисление веществ с выделением
теплоты и света.
Слайд 19
ВЗАИМОДЕЙСТВИЕ ПРОСТЫХ И СЛОЖНЫХ ВЕЩЕСТВ С
КИСЛОРОДОМ НАЗЫВАЕТСЯ ОКИСЛЕНИЕМ.
ГОРЕНИЕ —ХИМИЧЕСКАЯ РЕАКЦИЯ,ПРИ КОТОРОЙ ПРОИСХОДИТ ОКИСЛЕНИЕ ВЕЩЕСТВ С ВЫДЕЛЕНИЕМ ТЕПЛА И СВЕТА.
Слайд 20
SO2
- оксид серы(IV)
P2O5
- оксид фосфора(V)
Fe O
- оксид железа(II)
Fe2O3
-
оксид железа(III)
Оксиды – это сложные вещества, которые состоят
из двух элементов, одним из которых является кислород.
Слайд 22
ТЕСТ.
1. Самый распространенный х.э.:
а) водород в) кремний
б) кислород г) алюминий
2. Химический элемент кислород в природе распространен по массе:
а) 59% в) 49%
б) 94% г) 19%
Слайд 23 9. В лаборатории кислород получают:
а) р.соединения б) р.разложения
в) р.замещения г) р.обмена 10. В промышленности кислород получают: а) разложением воды б) разложением КМnO4 в) из воздуха
Слайд 24
3. Впервые кислород получил:
а)
А.Лавуазье в)М.Ломоносов
б) Д.Пристли
г) Р.Бойль 4. Относительная атомная масса кислорода:
а) 8 в) 16
б) 32 г) 15
Слайд 25 5. Валентность кислорода в соединениях:
а) II
в) III б) I г) V 6. Формула простого вещества кислорода: а) О в) Н2 б) О2 г) О3Слайд 26 7. Относительная молекулярная масса кислорода:
а) 8
в) 32 б) 16 г) 23 8. Определяют кислород: а) по цвету б) по запаху в) по вкусу г) тлеющей лучинкой
Слайд 27
Вопросы для закрепления.
Из перечисленных формул
веществ выпишите оксиды, и назовите их:
HCl, SO3, KOH, CO2, HBr, ZnO, NaOH, H2SO4, MgO, Al2O3, ZnS, K2O.Слайд 29 Вопросы к кроссворду: 1. Процесс взаимодействия простых и сложных
веществ с кислородом. 2. Английский ученный открывший кислород. 3. Вещество поддерживающее
горение. 4. Тип реакции 2Н2О→2Н2+О2. 5. вещества, получающиеся при горении. 6. Процесс сопровождающийся выделением тепла. 7. Тип реакции горения серы. 8. Самое распространенное вещество содержащее кислород.
Слайд 30
Ответить на вопросы.
Назовите химический
элемент, наиболее распространенный
в земной коре? В состав, каких
соединений входит этот элемент?2) Как получают кислород в лаборатории?
3) Что такое катализаторы, и каково их значение в химических
процессах?
4) Охарактеризуйте химические и физические свойства кислорода.
5) Какие процессы относятся к процессам окисления?
Какие вещества называются оксидами?