Слайд 2
Цели и задачи урока
повторить и закрепить знания, умения
и навыки по теме «Свойства водорода и кислот. Формулы
солей»;
продолжить формирование познавательных интересов учащихся;
продолжить формирование надпредметных (общеучебных) умений и навыков, таких, как обобщение, систематизация, сравнение;
продолжить совершенствование химического языка, умение наблюдать и объяснять химические явления;
развивать долговременную память и формировать сконцентрированное внимание;
выработать у учащихся понимание важности химических знаний в жизни;
формирование навыков коммуникативной культуры.
Слайд 3
План урока
Урок подготовлен в виде пьесы в 4
действиях.
Действующие лица и исполнители:
Обыватели и дилетанты - учащиеся 10-3
класса.
Главные оппоненты - учащиеся 8-4 класса.
Хранители знаний - учащиеся 10-3 класса.
Ведущий - учитель химии.
Слайд 4
Материалы проекта или урока
Действие первое
На скамейках в кабинете
химии справа сидят обыватели - дилетанты и ведут незатейливый
разговор:
1-ый: Вы слышали? В городе Кислород появился. Такой важный. Идет-
под ногами ничего не видит, ни на кого не смотрит.
2-ой: Как же, как же! Загордился! Было бы от чего. Он оказывается ,
газ, и, видите ли, только от него зависит жизнь на Земле!
3-ий: Ой, не говорите. На днях гуляю, а навстречу - кто вы думаете?
Водород! Не идет, а прямо- таки летит. Спрашиваю: "Ты куда?"
-''Кислород ищу".
- " Зачем он тебе?'' И, что вы думаете, он мне ответил?
На гремучее дело хочет его подбить, представляете? (Тихо, почти
шепотом) Так и сказал: «Гремучую смесь сделаем!».
1-ый: Ой, что будет, что будет!
3-ий: А потом говорит, может, повезет, и он оксид металла встретит.
Зачем-то он ему тоже нужен.
Слайд 5
Ведущий:
О чем идет разговор? Какие свойства остались без
внимания? Необходимо защитить знания о свойствах водорода и кислорода.
( К доске приглашаются два ученика для защиты опорных конспектов "Водород", "Кислород").
Слайд 6
А теперь проведем проверку знаний с помощью графического
диктанта.
Вариант 1. Кислород(O2) . Вариант 2. Водород (Н2) .
Хорошо растворяется
в воде.
Плохо растворяется в воде.
Легкий газ.
Тяжелый газ.
Горючий газ.
Газ, поддерживающий горение.
Восстановитель.
При смешении с O2 взрывается при обычных условиях.
Горит спокойно.
Взаимодействуете оксидом меди (||).
Собирают методом вытеснения воздуха.
Собирают в опрокинутый верх дном сосуд.
Собирают под водой.
Собирают в прямостоящий сосуд.
Слайд 7
Ответы:
Вариант 1:
Ответ «ДА»: 2,4,6,11,13,14
Ответ «НЕТ»: 1,3,5,7,8,9,10,12
Вариант 2:
Ответ «ДА»:
2,3,5,7,9,10,11,12,13
Ответ «НЕТ»: 1,4,6,8,14
Слайд 8
Ведущий: Выделите главное применение водорода? (ответы учеников...)
Ведущий: Для
экологии важен водород как источник чистой тепловой энергии в
будущем. Гидриды металлов - источники водородного топлива для автомобилей сегодня.
Слайд 9
Действие второе
Дилетанты - обыватели: Придумали в школе
изучать кислоты! К ним и прикасаться страшно, того
и гляди, съедят, не только мертвую, но и живую ткань! Б-р-р...
Ведущий:
Какие вещества называют кислотами?
Какие кислоты вы знаете? ( Вызывается ученик для защиты опорного конспекта "Кислоты''). Одновременно вызывается другой ученик для выполнения экспериментального задания:
'' В трех пронумерованных пробирках находятся растворы различных веществ. Определите, в какой пробирке кислота?".
Слайд 10
Ведущий:
Назовите номера практически возможных реакций.
Обоснуйте правильность ответа.
Аl + НСl -->
Сu + H2SO4 -->
СuО + H2SO4 -->
Ag + H3PO4 -->
Аl2O3 + HNO3 -->
Fe2O3 + HCl -->
P2O5 + HNO3 -->
Слайд 11
Ведущий: А сами то мы можем составлять уравнения
реакций?
К доске приглашается один ученик для выполнения задания.
"Даны:
Mg,
HCl MgO, Cu, CuO.
Напишите уравнения возможных реакций, укажите условия их течения".
(класс выполняет это же задание в тетрадях и проверяет правильность на доске)
Ведущий: Что за вещества образовались в результате взаимодействия Mg, MgO, CuO с соляной кислотой?
Конец второго действия
Слайд 12
Действие третье
Беседу с классом проводят дилетанты - обыватели.
1-ый: Ты знаешь соль?
2-ой: Знаю.
1-ый: А какая
она?
2-ой: Белая крупинками, а самое главное - соленая.
3-ий: Ее еще в пищу добавляют.
1-ый: Я не понимаю. Так она, что - одна?
2-ой: Конечно, одна - единственная.
1-ый: А почему они говорят о солях? Значит их много?
Слайд 13
Фронтальная беседа
Сколько же известно солей?
Каков состав солей?
Из перечня
веществ назовите только формулы солей:
1)СаО 2)Ca(NO3)2 3)Са(ОН)2
4)
FeCl2 5) НСl 6) Н2O
7)ZnS 8)H2SO4 9)CuSO4
10) Мg3(Р04)2 11)HgCl2 12)K2CO3
Представители еще каких классов веществ есть в задании?
Назовите оксиды, кислоты.
Какое вещество по составу мы не сможем отнести ни к одному известному нам классу веществ.(Са(ОН)2, будем изучать его в следующей теме).
Как дают название соли?
Как составить формулу соли?
Слайд 14
Ведущий:
Впереди вас ждет «скоростная дорожка». Перед ней проведем
химическую разминку.
Химическая разминка.
Учащиеся составляют формулы солей и дают
им названия.
Для этого ведущий показывает сигнальные карточки:
Na, К, Са, Ва, Zn, Mg, Fe, Сu, Pb, =SO4 , = S, =SO3, = NO3, = CO3, =Cl, = PO4 ; = SiO3.
(3 минуты)
Слайд 15
Ведущий: Давайте определим, кто лучший спортсмен в химии?
Ведущий
обращает внимание учащихся на две "скоростные дорожки"(записаны на бумаге):
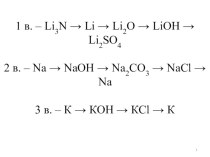
1:
NaCl, К2С03. Ba(N03)2, MgCl2 , Li3 P04. CuCl2
2: CuS04, Ca(N03)2 , FeCl3 , K2S03, Na2Si03, ZnS.
Желающие выполнить задание получают карточки ( в соответствии с содержанием одной из хим.дорожек). Они должны дать название соли, сопровождая этим каждый шаг (по секундомеру замеряют время выполнения задания каждым учеником).