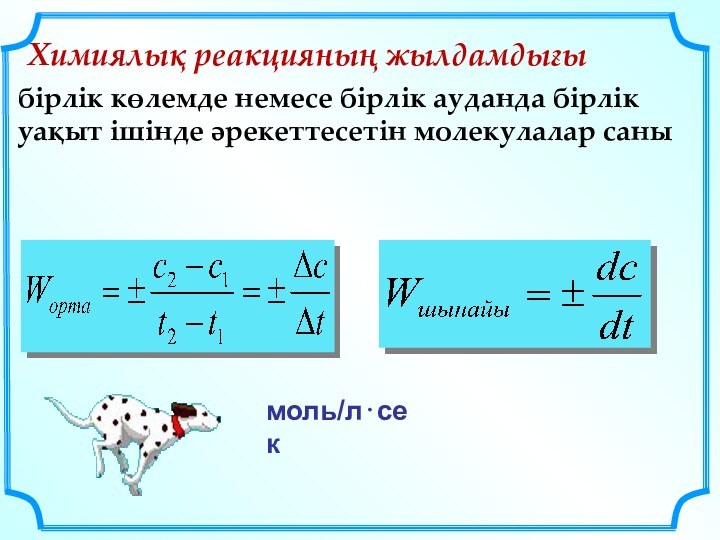
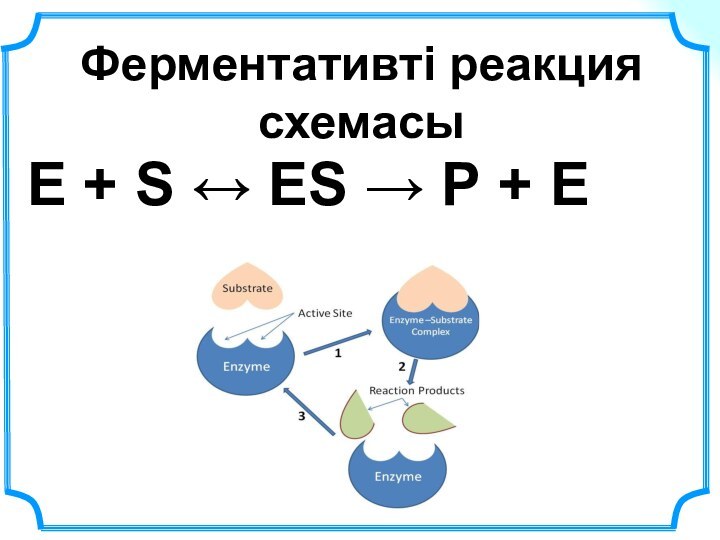
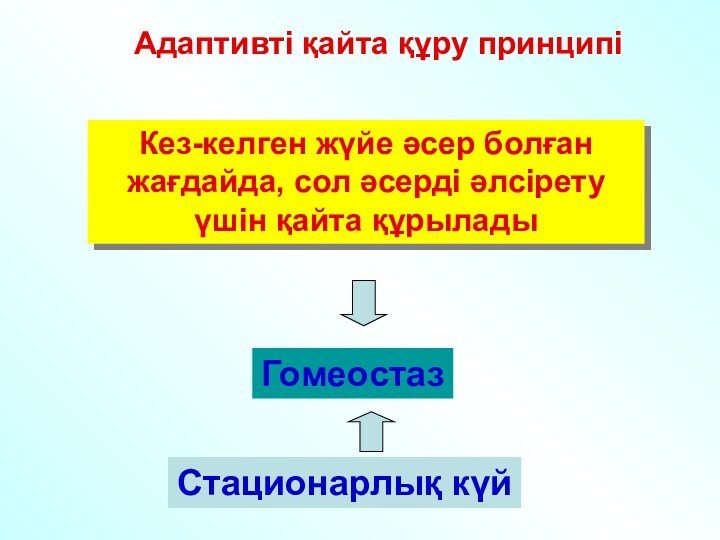
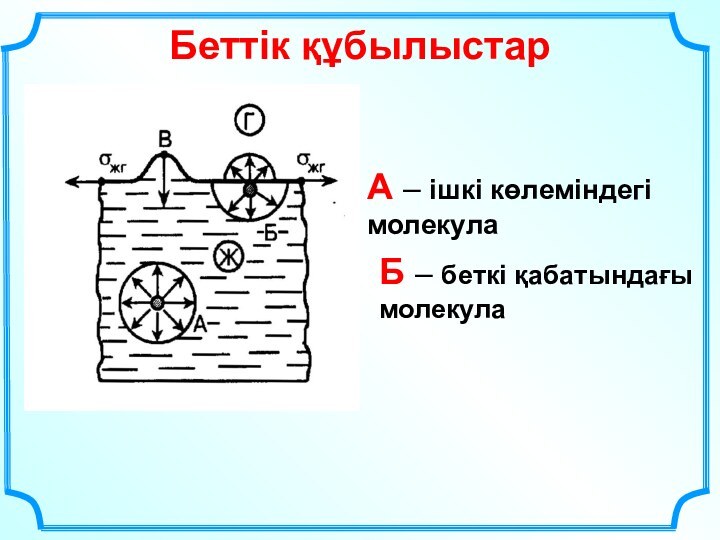
да процестерді зерттеу мен түсіну үшін қажетті инструмент болып
табылатын іргелі сала.Тірі ағзада қалыпты жағдайда және патология кезінде болатын құбылыстарды тек қана ондағы жүретін химиялық процестерді зерттеу және бағалау арқылы түсінуге болады, ал емдеу тек қана химиялық құралдардың көмегімен ғана жүзеге асырылады
Парацельс