Слайд 2
Современное изучение структуры белка
В XXI веке исследование белков

перешло на качественно новый уровень, когда исследуются не только
индивидуальные белки, но и одновременное изменение количества и пост трансляционные модификации большого числа белков отдельных клетокВ XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные белки, но и одновременное изменение количества и пост трансляционные модификации большого числа белков отдельных клеток, тканейВ XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные белки, но и одновременное изменение количества и пост трансляционные модификации большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой.
С помощью методов биоинформатики стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности.
В настоящее время электронная микроскопия больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.
Слайд 3
Первичная структура белков
Молекулы белка трехмерны и имеют несколько
уровней организации.
Первичная структура – порядок чередования (последовательность) аминокислот в
полипептидной цепи, соединенных между собой пептидными связями.
Первичная структура индивидуальна для различных белков.
Слайд 4
Линейные полипептидные цепи белков за счет взаимодействия функциональных
групп аминокислот приобретают определенную пространственную структуру, называемую «конформация».
Все
молекулы белков, имеющих одинаковую первичную структуру имеют одинаковую конформацию.
В белках различают 2 основных типа конформации полипептидных цепей: вторичную и третичную структуры.
Конформация белков
Слайд 5
Вторичная структура
Между присутствующими в полимерной цепи амино-группами HN
и карбонильными группами CO возникают водородные связи в результате
молекула белка приобретает определенную пространственную форму, называемую вторичной структурой.
Слайд 6
Механизм возникновения водородных связей можно показать на примере

взаимодействия двух молекулМеханизм возникновения водородных связей можно показать на
примере взаимодействия двух молекул воды.
В диполе водыВ диполе воды, как известно, избыток положительных зарядов приходится на атомыВ диполе воды, как известно, избыток положительных зарядов приходится на атомы водородаВ диполе воды, как известно, избыток положительных зарядов приходится на атомы водорода, а избыток отрицательных – на атомыВ диполе воды, как известно, избыток положительных зарядов приходится на атомы водорода, а избыток отрицательных – на атомы кислорода.
При достаточном сближении двух молекулПри достаточном сближении двух молекул водыПри достаточном сближении двух молекул воды возникает электростатическое взаимодействие между атомомПри достаточном сближении двух молекул воды возникает электростатическое взаимодействие между атомом кислородаПри достаточном сближении двух молекул воды возникает электростатическое взаимодействие между атомом кислорода одной молекулыПри достаточном сближении двух молекул воды возникает электростатическое взаимодействие между атомом кислорода одной молекулы и атомомПри достаточном сближении двух молекул воды возникает электростатическое взаимодействие между атомом кислорода одной молекулы и атомом водородаПри достаточном сближении двух молекул воды возникает электростатическое взаимодействие между атомом кислорода одной молекулы и атомом водорода второй молекулыПри достаточном сближении двух молекул воды возникает электростатическое взаимодействие между атомом кислорода одной молекулы и атомом водорода второй молекулы воды.
Следствием этого является ослабление связи между атомамиСледствием этого является ослабление связи между атомами водородаСледствием этого является ослабление связи между атомами водорода и кислородаСледствием этого является ослабление связи между атомами водорода и кислорода в каждой молекулеСледствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле водыСледствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомомСледствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомом водородаСледствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомом водорода первой молекулыСледствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомом водорода первой молекулы и атомомСледствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомом водорода первой молекулы и атомом кислородаСледствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомом водорода первой молекулы и атомом кислорода второй молекулыСледствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомом водорода первой молекулы и атомом кислорода второй молекулы воды. Эту непрочную связь принято обозначать водородной связью.
Слайд 7
Наиболее распространены два типа вторичной структуры белков.
Первый
вариант, называемый a-спиралью, реализуется с помощью водородных связей внутри
одной полимерной молекулы. Водородные связи формируются между 1-й и 4-й аминокислотами.
В результате стягивающего действия водородных связей молекула приобретает форму спирали – так называемая a-спираль, ее изображают в виде изогнутой спиралевидной ленты, проходящей через атомы, образующие полимерную цепь.
a-спираль представляет собой самый жесткий тип вторичной структуры , преобладает во многих белках.
Слайд 8
Другой вариант вторичной структуры - β - структура.
Образуется между атомами пептидных групп линейных областей одной полипептидной
цепи (левый рис. ), делающий изгибы или между разными полипептидными цепями. В изгибах чаще всего находится пролин. Поскольку полипептидная цепь имеет направление, возможны варианты, когда направление цепей совпадает (параллельная β –структура, (справа рис. Б), либо они противоположны (антипараллельная β – структура, рис.А)
Слайд 9
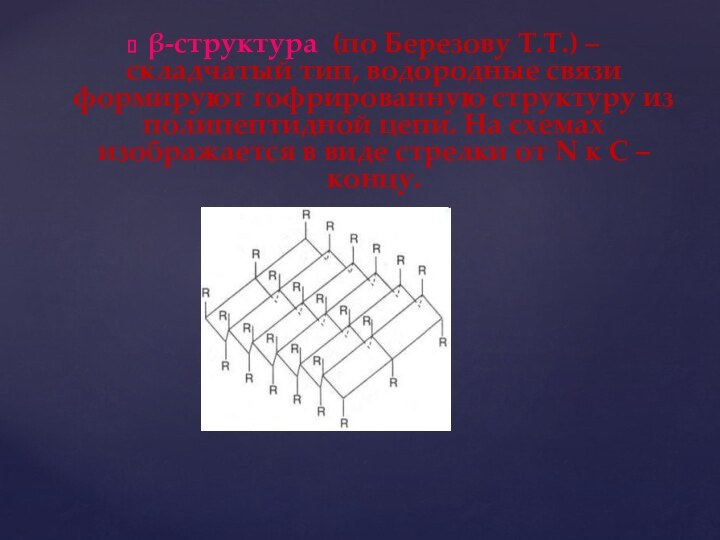
β-структура (по Березову Т.Т.) – складчатый тип, водородные
связи формируют гофрированную структуру из полипептидной цепи. На схемах
изображается в виде стрелки от N к С – концу.
Слайд 10
В белках отмечают области с нерегулярной структурой белка,
которые часто называют «беспорядочные клубки»
Содержание разных типов вторичных структур
1. Содержат только a- спирали
(Hb и миоглобин)
2. Содержат a-спирали и β - структуры. (лактатдегидрогеназа)
3. Содержат только β - структуры.
4. Мало регулярных вторичных структур.
Слайд 11
Супервторичные структуры.
Специфический порядок формирования вторичных структур называют супервторичной
структурой белка.
Различают:
тип a/β – бочонка, «цинковый палец», лейциновая застежка
и др.
Слайд 12
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной
спирали или способ укладки полипептидной цепи в определенном объеме.
Присуща всем глобулярным белкам.
Слайд 13
Типы нековалентных связей, стабилизирующих третичную структуру белка.
1 –
ионные связи; 2 - водородная связь; 3 - гидрофобные
взаимодействия неполярных групп;
4 - дисульфидная (ковалентная) связь.
Слайд 14
Наиболее важные водородные связи образуются между атомомобразуются между
атомом водородаобразуются между атомом водорода, несущим частичный положительный заряд,
и отрицательно заряженным атомомобразуются между атомом водорода, несущим частичный положительный заряд, и отрицательно заряженным атомом кислорода в белковой молекуле.
Ниже представлены примеры водородных связей, которые могут еще образовываться в белковой молекуле:
а) между пептидными цепями;
б) между двумя гидроксильными группами;
в) между ионизированной СООН-группой и ОН-группой тирозина;
г) между ОН-группой серина г) между ОН-группой серина и пептидной связью.
Слайд 15
Дисульфидные связи в структуре инсулина человека
Слайд 16
Первым белком, третичная структура которого была выяснена Дж.

Кендрью на основании рентгеноструктурного анализа, оказался миоглобин кашалота.
Это
сравнительно небольшой белок Это сравнительно небольшой белок с мол. м. 16700, содержащий 153 аминокислотных остатка (полностью выяснена первичная структура), представленный одной полипептидной цепью. Основная функция миоглобина Это сравнительно небольшой белок с мол. м. 16700, содержащий 153 аминокислотных остатка (полностью выяснена первичная структура), представленный одной полипептидной цепью. Основная функция миоглобина – перенос кислорода Это сравнительно небольшой белок с мол. м. 16700, содержащий 153 аминокислотных остатка (полностью выяснена первичная структура), представленный одной полипептидной цепью. Основная функция миоглобина – перенос кислорода в мышцах. Полипептидная цепь мио-глобина представлена в виде изогнутой трубки, компактно уложенной вокруг гема Это сравнительно небольшой белок с мол. м. 16700, содержащий 153 аминокислотных остатка (полностью выяснена первичная структура), представленный одной полипептидной цепью. Основная функция миоглобина – перенос кислорода в мышцах. Полипептидная цепь мио-глобина представлена в виде изогнутой трубки, компактно уложенной вокруг гема (небелковый компонент, содержащий железо)
Модель третичной структуры молекулы Модель третичной структуры молекулы миоглобина Модель третичной структуры молекулы миоглобина (по Дж. Кендрью). Латинскими буквами обозначены структурные домены Модель третичной структуры молекулы миоглобина (по Дж. Кендрью). Латинскими буквами обозначены структурные домены, красным цветом – гем
Слайд 17
Если полипептидная цепь содержит более 200 аминокислот, то
ее пространственная структура сформированы в виде доменов.
Домен – это
компактная глобулярная структурная единица внутри полипептидной цепи.
ДоменыДомены могут выполнять разные функции и подвергаться складыванию (свертыванию) в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы.
Открыто много белковОткрыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменовОткрыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами.
Домены определяются на генетическом уровне – экзонами.
Слайд 18
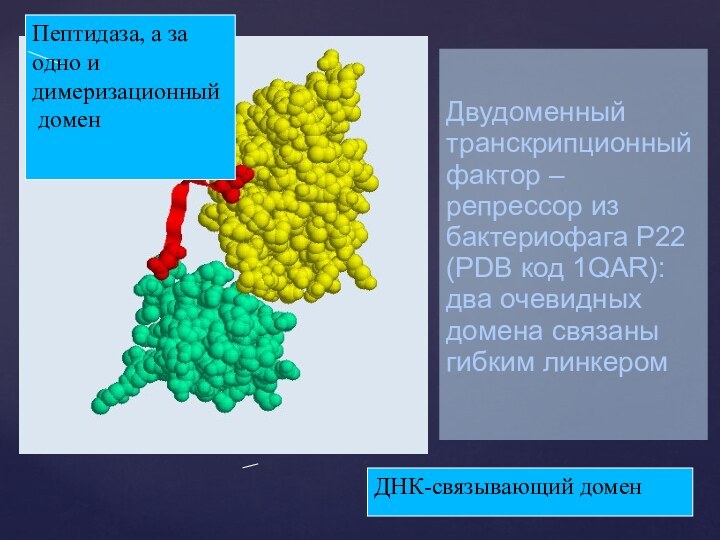
Двудоменный транскрипционный фактор – репрессор из бактериофага P22
(PDB код 1QAR):
два очевидных домена связаны гибким линкером
ДНК-связывающий
домен
Пептидаза, а за одно и димеризационный
домен
Слайд 19
Под четвертичной структурой подразумевают способ укладки в пространстве
отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной
или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования.
Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью.
Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку.
Образовавшуюся молекулу принято называть олигомером.
Слайд 20
Олигомерные белки
Олигомерные белки чаще построены из четного числа
протомеров (от 2 до 4, реже от 6 до
8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч.
В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер.
Слайд 21
Уровни организации белковой молекулы.
Линейная последовательность аминокислотных остатков в
полипептидной цепи называют первичной структурой белка.
Слайд 22
Уровни организации белковой структуры: первичная структура (аминокислотная последовательность),
вторичная структура (a-спираль и один тяж b-структуры), третичная структура
глобулы, сложенной одной цепью, и четвертичная структура олигомерного (в данном случае - димерного) белка.
Слайд 23
Таким образом, линейная одномерная структура полипептидной цепи (т.е.
последовательность аминокислотных остатков, обусловленная кодом белкового синтеза) наделена информацией
другого типа – конформационной, которая представляет собой образование белковой молекулы строго заданной формы с определенным пространственным расположением отдельных ее частей.
Слайд 24
Фолдинг - процесс пространственной укладки синтезированной полипептидной цепи,
формирование единственно возможной нативной структуры белка.
В клетках происходит
отбор из множества стерически возможных состояний одной-единственной стабильной и биологически активной конформации, определяемой, вероятнее всего, первичной структурой.
В фолдинге участвуют белки - шапероны.
И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Слайд 26
Участие шаперонов в фолдинге белка.
Предполагается, что основными функциями
шаперонов являются способность предотвращать образование из полипептидной цепи неспецифических
(хаотичных) беспорядочных клубков, или агрегатов белковПредполагается, что основными функциями шаперонов являются способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков, или агрегатов белков, и обеспечение доставки (транспорта) их к субклеточным мишеням, создавая условия для завершения свертывания белковой молекулы.
Слайд 27
Изображение модели комплекса бактериальных шаперонов GroES и GroEL
(вид сверху). Аггрегированный белок поступает в центральную полость комплекса,
где в результате гидролиза АТФ происходит изменение его структуры.
Шапероны удерживают белки в развернутом состоянии.
Взаимодействие шаперонов с синтезируемым белком начинается еще до схождения полипептидной цепи с рибосомы
Связываясь с отдельными участками «опекаемой» ими полипептидной цепи, молекулы hsp70 образуют прочные комплексы, удерживающие цепь в развернутом состоянии.
Главная функция hsp70 состоит в удержании вновь синтезируемых белков от неспецифической агрегации и в их передаче другому «белку-помощнику», шаперонину, роль которого - обеспечить оптимальные условия для эффективного сворачивания
Слайд 28
Вновь синтезированный белок или полипептид не всегда функционально
активны и требуют дополнительных преобразований, включающих:
Фолдинг молекул.
Образование дисульфидных
мостиков между остатками цистеина.
Частичный протеолиз.
Присоединение простетической группы. Сборка протомеров в олигомерный белок.
Модификацию аминокислотных остатков: фосфорилирование, гидроксилирование и другие реакции.
Пострансляционная модификация белков
Слайд 29
Деградация белков - Убиквитиновый сигнальный путь
Белок выполняет
закреплённую за ним функцию, а затем, в определённый момент,
клетке необходимо от него избавиться. Последнее обусловлено рядом причин:
во - первых, дальнейшая активность белка может навредить клетке, во - вторых, нужно синтезировать новые белки,
а перегрузка цитоплазмы полипептидами является источником апоптоза.
Внутриклеточную деградацию белков долгое время считали неспецифическим случайным процессом.
Настоящим прорывом в данной области послужило открытие убиквитинового сигнального пути. В рамках этого пути деградации белка, которая осуществляется крупным белковым комплексом - протеосомой, предшествует присоединение к нему "цепочки"молекул небольшого пептида убиквитина.