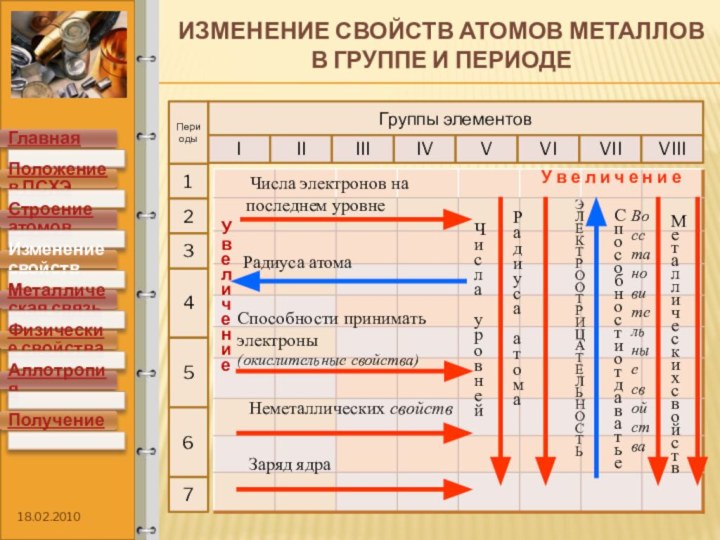
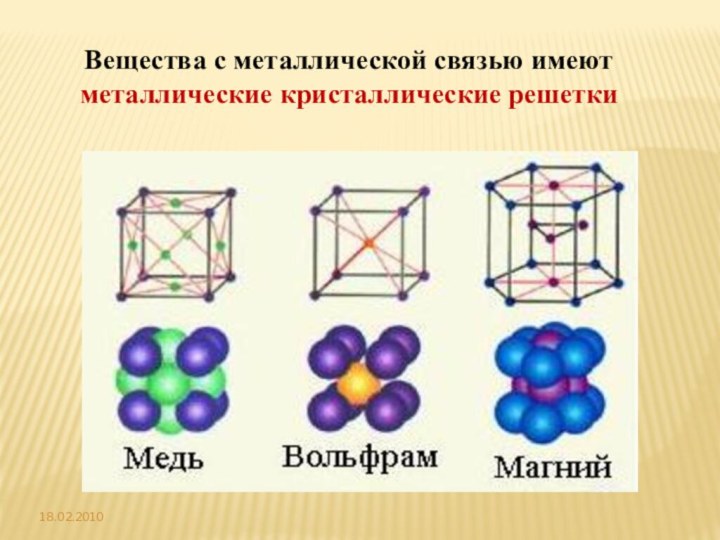
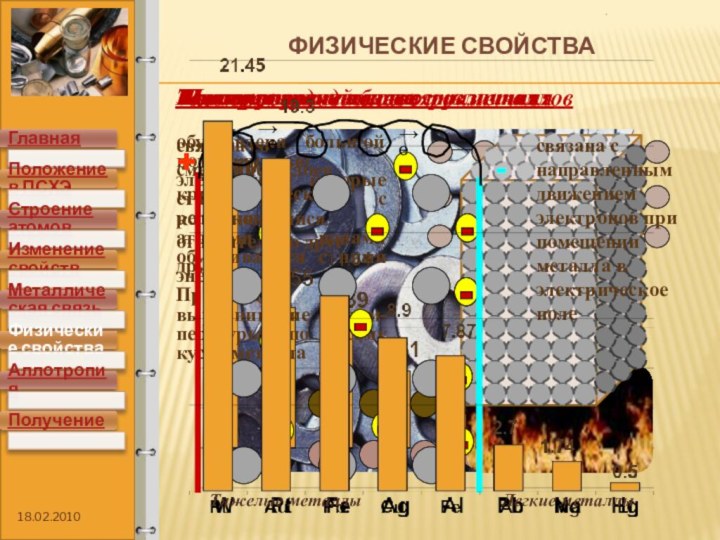
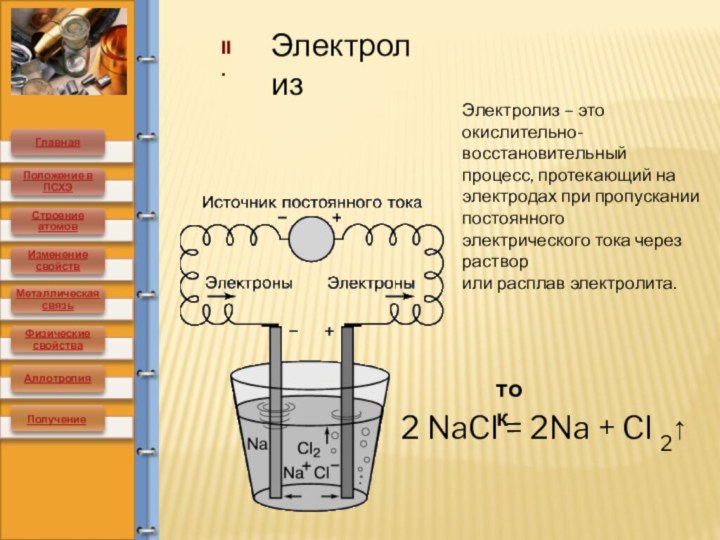
элементов
VII
VIII
Периоды
At
I
Rn
Xe
Te
Ra
Ba
Fr
Cs
Pt
Tl
La
In
Ac
Sn
Cd
Ag
Ir
Os
Re
W
Ta
Hf
Sb
Bi
Pb
Hg
Au
Bh
Sg
Db
Rf
Po
Задание: рассмотрите положение элементов в ПСХЭ.
Какие периоды содержат металлы? В каких группах они расположены?