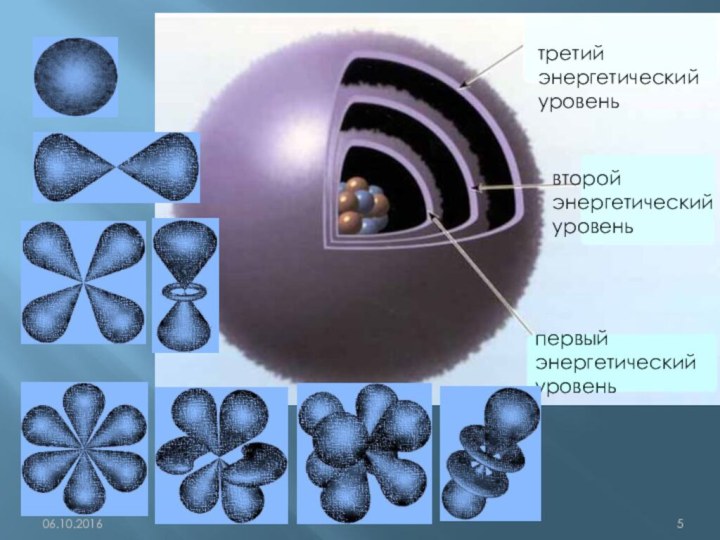
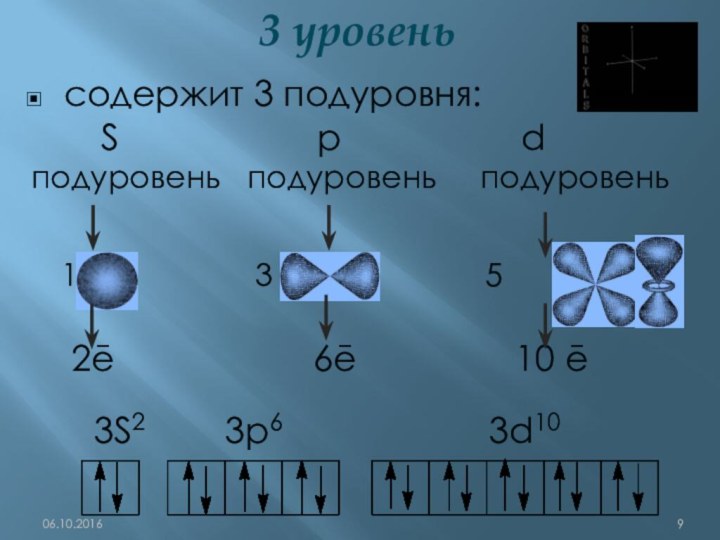
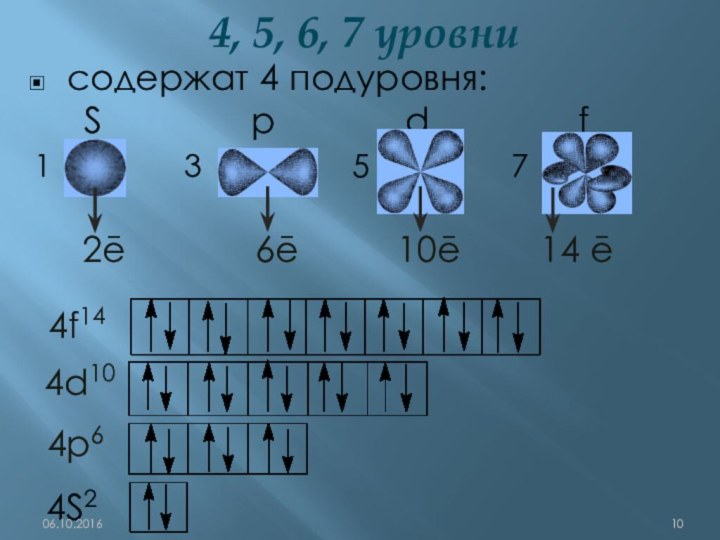
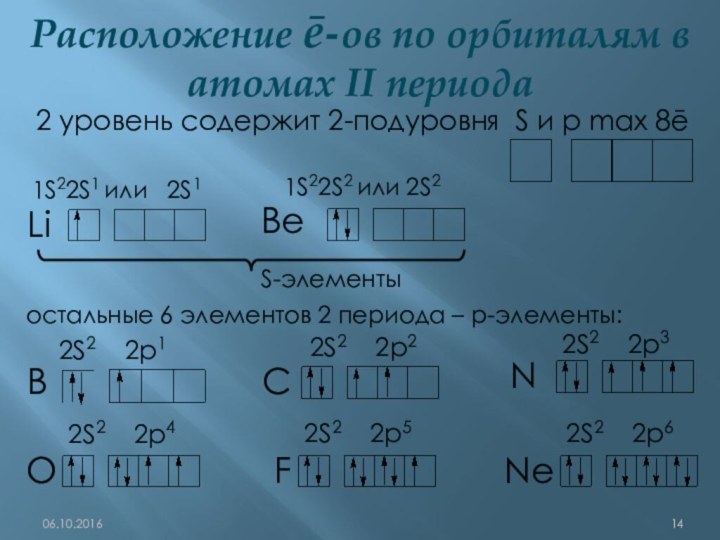
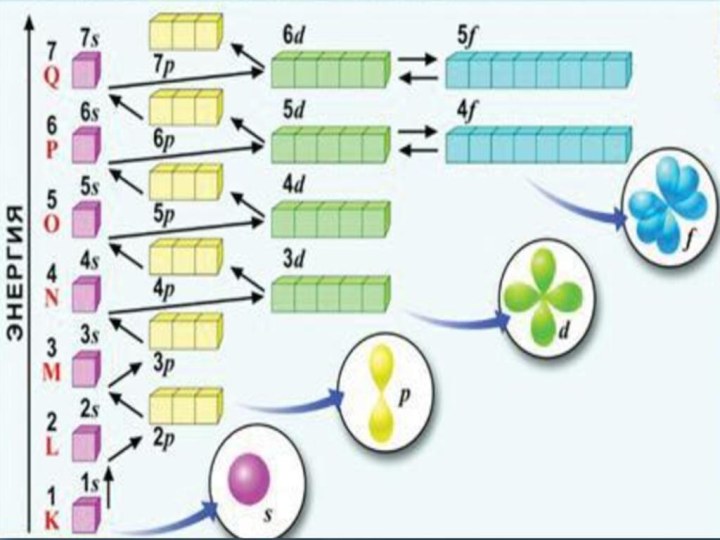
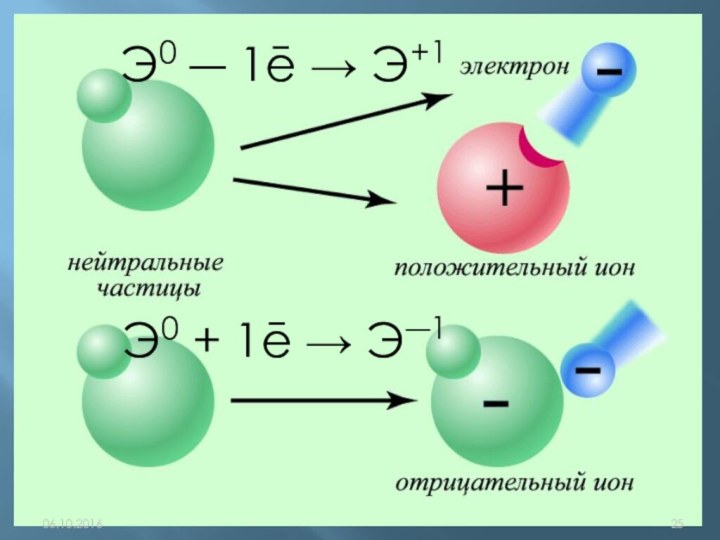
q(ē)= ─1,6•10-19Кл
как волна: характерны явления дифракции и интерференции;
для движущегося ē невозможно точно определить местоположение и скорость движения;
у разных ē разный запас Евнутр.;
Ученые обнаружили, что электроны имеет форму практически идеальной сферы.