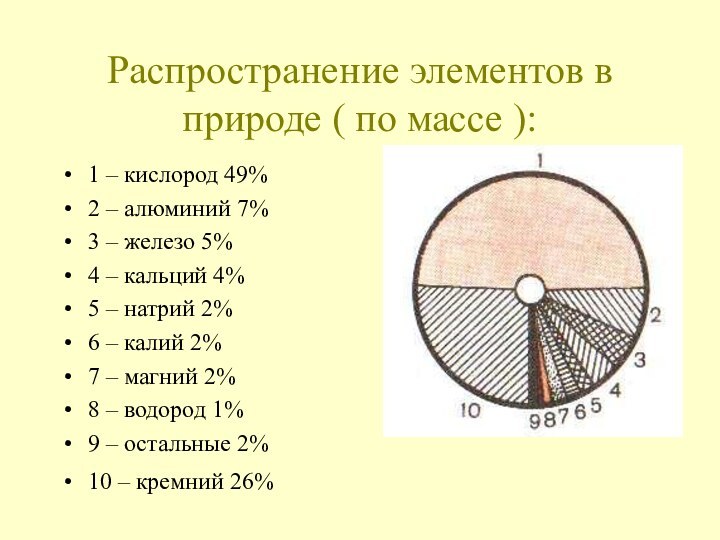
Природный кислород состоит из смеси трех стабильных нуклидов с
массовыми числами 16 (доминирует в смеси, его в ней 99,759 % по массе), 17 (0,037%) и 18 (0,204%). Радиус нейтрального атома кислорода 0,066 нм. Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кислорода 2 s 2 р 4. Энергии последовательной ионизации атома кислорода 13,61819 и 35,118 эВ, сродство к электрону 1,467 эВ. Радиус иона О2-при разных координационных числах от 0,121 нм (координационное число 2) до 0,128 нм (координационное число 8). В соединениях проявляет степень окисления -2 и, реже, -1. По шкале Полинга, электроотрицательность кислорода 3,5 (второе место среди неметаллов после фтора ).В свободном виде кислород — газ без цвета, запаха и вкуса.