- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Кислоты
Содержание
- 2. 1. Определение и классификация2. Отдельные представители3. Обнаружение кислот4.Техника безопасности 5. Типичные реакции кислот7. Проверка знанийКислоты
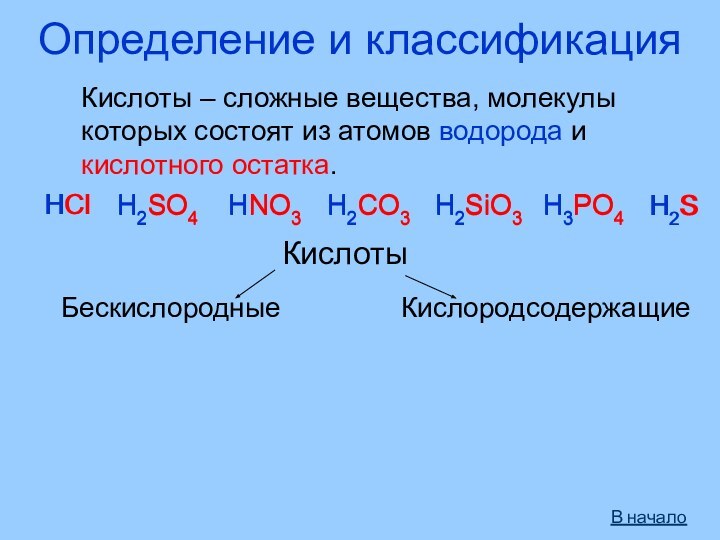
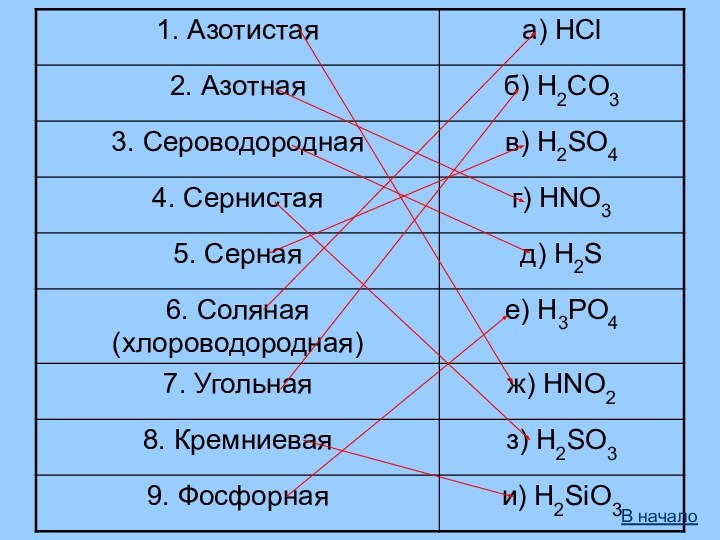
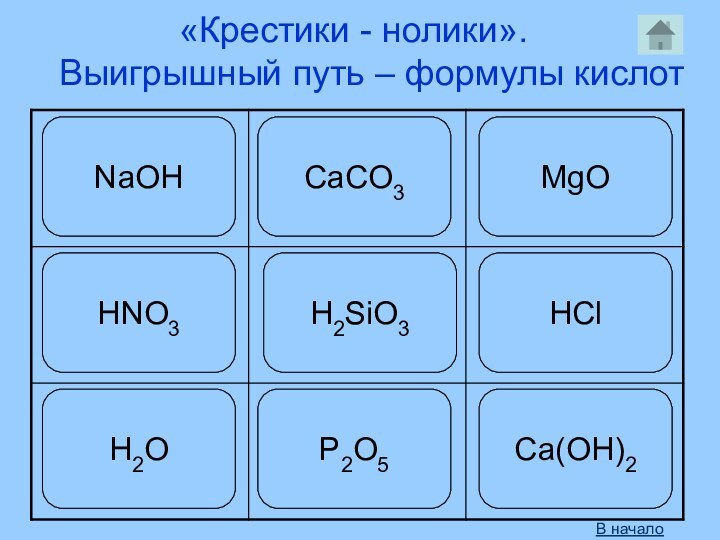
- 3. Определение и классификацияКислоты – сложные вещества, молекулыкоторых состоят из атомов водорода и кислотного остатка.HClH2SO4HNO3H2CO3H2SiO3H3PO4HClH2SO4HNO3H2CO3H2SiO3H3PO4КислотыБескислородныеH2SH2SКислородсодержащиеВ начало
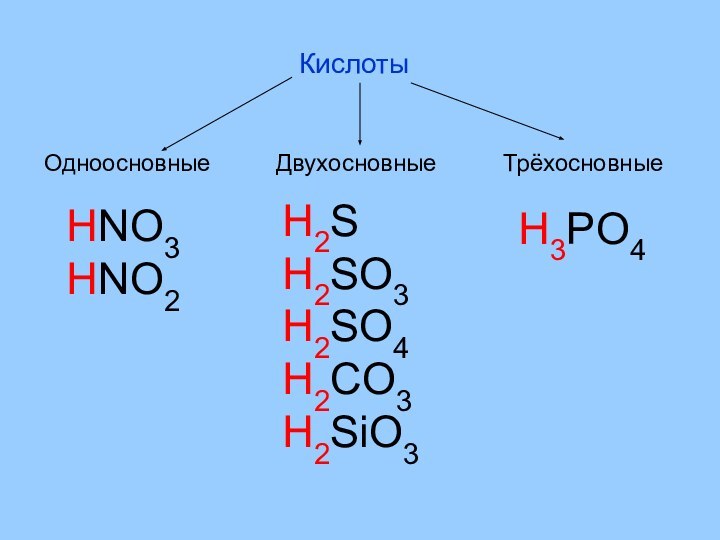
- 4. КислотыОдноосновныеДвухосновныеТрёхосновныеHNO3HNO2H2SH2SO3H2SO4H2CO3H2SiO3H3PO4
- 5. Органические кислоты, встречаемые вами в повседневной жизниЩавелеваяЛимоннаяУксуснаяМолочнаяАскорбиноваяВ начало
- 6. Серная кислота – бесцветнаяжидкость, вязкая, как масло,
- 7. Угольная кислотаH2CO3УГОЛЬНАЯ КИСЛОТА - очень слабая и
- 8. СОЛЯНАЯ КИСЛОТА - бесцветная, «дымящая» на воздухе жидкость. Составная часть желудочного сока. Соляная кислотаНClВ начало
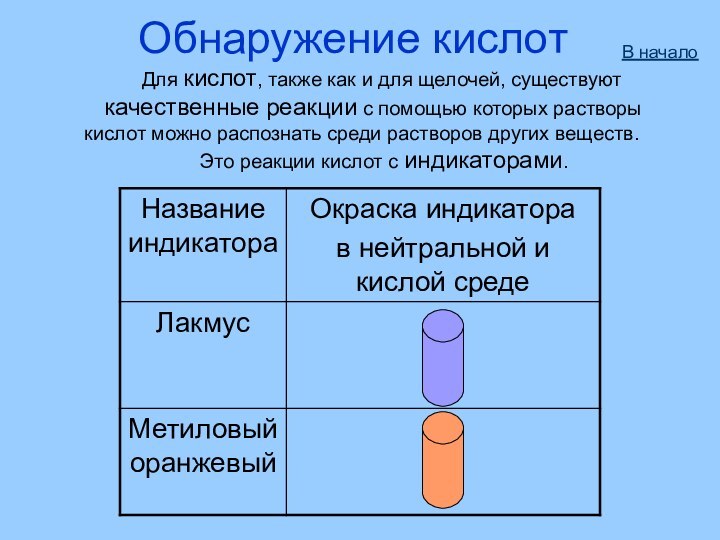
- 9. Обнаружение кислот Для кислот, также
- 10. Техника безопасностиПри растворении серной кислоты нужно вливать
- 11. Типичные реакции кислот1. Кислота + основание →
- 12. В начало
- 13. Каким правилом техники безопасности пренебрёг
- 14. Скачать презентацию
- 15. Похожие презентации
1. Определение и классификация2. Отдельные представители3. Обнаружение кислот4.Техника безопасности 5. Типичные реакции кислот7. Проверка знанийКислоты









Слайд 2
1. Определение и классификация
2. Отдельные представители
3. Обнаружение кислот
4.Техника
безопасности
Слайд 3
Определение и классификация
Кислоты – сложные вещества, молекулы
которых состоят
из атомов водорода и
кислотного остатка.
HCl
H2SO4
HNO3
H2CO3
H2SiO3
H3PO4
HCl
H2SO4
HNO3
H2CO3
H2SiO3
H3PO4
Кислоты
Бескислородные
H2S
H2S
Кислородсодержащие
В начало
Слайд 5
Органические кислоты, встречаемые вами
в повседневной жизни
Щавелевая
Лимонная
Уксусная
Молочная
Аскорбиновая
В начало
Слайд 6
Серная кислота – бесцветная
жидкость, вязкая, как масло, не
имеющая
запаха, почти вдвое тяжелее воды.
Серная кислота поглощает влагу из
воздуха
и других газов. Это свойствосерной кислоты используют для осушения
некоторых газов.
В начало
H2SO4
Серная кислота
Слайд 7
Угольная кислота
H2CO3
УГОЛЬНАЯ КИСЛОТА - очень слабая
и непрочная
кислота.
Образуется при растворении диоксида
углерода в воде, например,
в минеральнойводе.
В начало
Слайд 8
СОЛЯНАЯ КИСЛОТА - бесцветная,
«дымящая» на воздухе жидкость.
Составная часть желудочного сока.
Соляная кислота
НCl
В начало
Слайд 9
Обнаружение кислот
Для кислот, также как
и для щелочей, существуют
качественные реакции с
помощью которых растворыкислот можно распознать среди растворов других веществ.
Это реакции кислот с индикаторами.
В начало
Слайд 10
Техника безопасности
При растворении серной кислоты нужно вливать её
тонкой струёй в воду при
помешиванииВ начало
Слайд 11
Типичные реакции кислот
1. Кислота + основание → соль
+ вода
Н Сl
+
Na OH
→
Н
Сl
Na
OH
+
2. Кислота + оксид металла →
соль + водаH Cl
+
Mg O
→
Mg
O
H
Cl
+
(H2O)
2
2
2
3. Кислота + металл → соль + водород
H Cl
+
Mg
→
H
Cl
Mg
2
+
2
2
4. Кислота + соль → новая кислота + новая соль
Ag NO3
+
H Cl
H
Cl
Ag
NO3
→
+
В начало