- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему:Спирты
Содержание
- 2. План урокаОпределениеКлассификация спиртовГомологический рядНоменклатура спиртовИзомерия спиртовХимические свойства
- 3. Определение Спирты́ (устаревшее алкого́ли) — органические соединения,
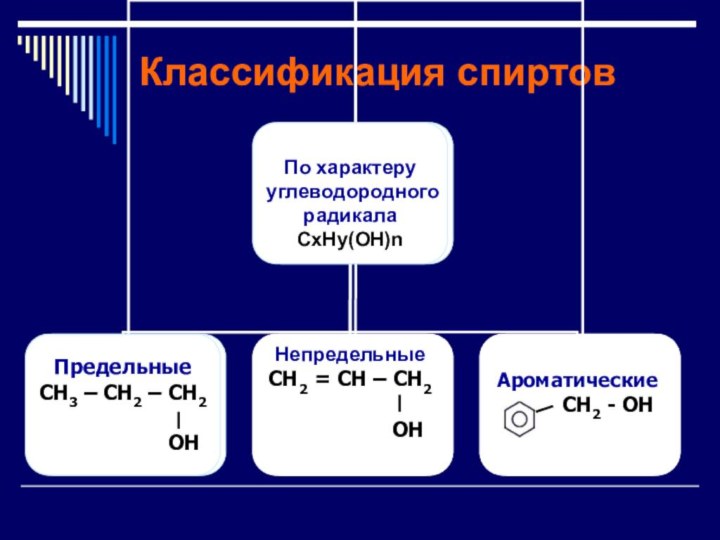
- 4. Классификация спиртов
- 5. Классификация спиртов
- 6. Номенклатура спиртов Просмотрите таблицу и сделайте вывод о номенклатуре спиртов
- 7. НоменклатураНазвания одноатомных спиртов образуются из названия углеводорода
- 8. Гомологический рядСН3-ОН метиловый спирт, метанолСН3-СН2-ОН этиловый спирт,этанолСН3-СН2-СН2ОН
- 9. Виды изомерии Структурная 1. Углеродной цепи 2. Положения функциональной группы
- 10. Химические свойства1. РЕАКЦИЯ ГОРЕНИЯС2Н5ОН +О2=2. РЕАКЦИЯ ОКИСЛЕНИЯС2Н5ОН + [О ] = СН3-СОН +Н2О
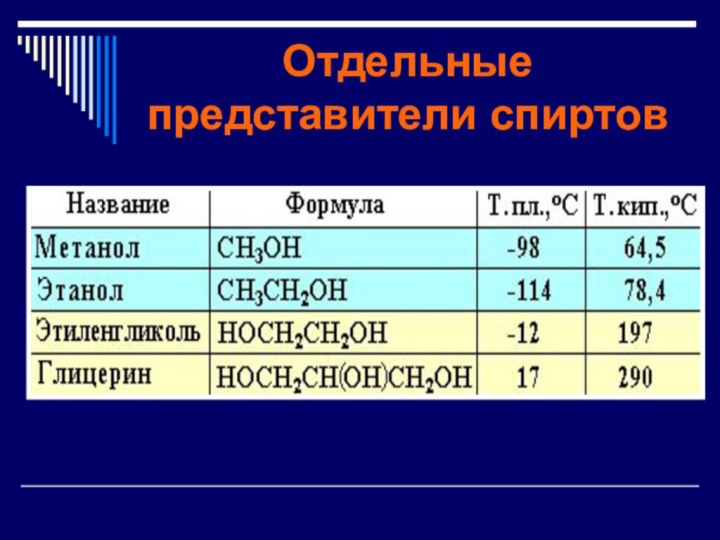
- 11. Отдельные представители спиртов
- 12. Представители
- 13. Одноатомный спирт - метанолЖидкость без цвета с
- 14. Метанол - ядЯдовитое действие метанола основано на
- 15. Одноатомный спирт - этанолБесцветная жидкость с характерным
- 16. Применение этанола Этиловый спирт употребляется при приготовлении
- 17. Вредное воздействие этанола В начале опьянения страдают
- 18. Вредное воздействие этанолаИзменения структуры мозга, вызванные многолетней
- 19. Вредное воздействие этанолаАлкоголь крайне неблагоприятно влияет на
- 20. Многоатомный спирт -этиленгликольЭтиленгликоль — представитель предельных двухатомных
- 21. Применение этиленгликоляВажным свойством этиленгликоля является способность понижать
- 22. Этиленгликоль - яд Дозы вызывающие смертельное отравление
- 23. Многоатомный спирт - глицеринГлицерин – трехатомный предельный
- 24. Применение глицеринаПрименяется в производстве взрывчатых веществ нитроглицерина.При
- 25. Качественная реакция на многоатомные спирты
- 26. Качественная реакция на многоатомные спиртыРеакцией на многоатомные
- 27. Задания Заполните рабочую карту к уроку.Ответьте на вопросы теста.Разгадайте кроссворд.
- 28. Скачать презентацию
- 29. Похожие презентации
План урокаОпределениеКлассификация спиртовГомологический рядНоменклатура спиртовИзомерия спиртовХимические свойства Отдельные представители(Физические свойства, химические свойства







![Презентация по химии на тему:Спирты Химические свойства1. РЕАКЦИЯ ГОРЕНИЯС2Н5ОН +О2=2. РЕАКЦИЯ ОКИСЛЕНИЯС2Н5ОН + [О ] = СН3-СОН +Н2О](/img/tmb/7/602631/2fd6c4670e24dad42b707fa7b6c9f502-720x.jpg)

















Слайд 2
План урока
Определение
Классификация спиртов
Гомологический ряд
Номенклатура спиртов
Изомерия спиртов
Химические свойства
Отдельные
представители
химические свойства
Слайд 3
Определение
Спирты́ (устаревшее алкого́ли) — органические соединения, содержащие
одну или несколько гидроксильных групп ( OH),связанных с атомом
углерода в углеводородном радикале.Общая формула спиртов СxHy(OH)n.
Слайд 7
Номенклатура
Названия одноатомных спиртов образуются из названия углеводорода с
самой длинной углеродной цепью, содержащей гидроксильную группу, путём добавления
суффикса -ол.Для многоатомных спиртов перед суффиксом -ол по-гречески (-ди-, -три-, ...) указывается количество гидроксильных групп.
Например: CH3-CH2-OH этанол
Слайд 8
Гомологический ряд
СН3-ОН метиловый спирт, метанол
СН3-СН2-ОН этиловый спирт,этанол
СН3-СН2-СН2ОН пропиловый
спирт,
Пропанол-1
СН3-СН2-СН2-СН2ОН бутиловый спирт, бутанол-1
СН3-СН2-СН2- СН2-СН2-ОН пентиловый спирт,пентанол-1
Слайд 10
Химические свойства
1. РЕАКЦИЯ ГОРЕНИЯ
С2Н5ОН +О2=
2. РЕАКЦИЯ ОКИСЛЕНИЯ
С2Н5ОН +
[О ] = СН3-СОН +Н2О
Слайд 13
Одноатомный спирт - метанол
Жидкость без цвета с температурой
кипения 64С, характерным запахом Легче воды. Горит бесцветным пламенем.
Применяется
в качестве растворителя и топлива в двигателях внутреннего сгорания.
Слайд 14
Метанол - яд
Ядовитое действие метанола основано на поражении
нервной и сосудистой системы. Приём внутрь 5—10 мл метанола
приводит к тяжёлому отравлению, а 30 мл и более — к смерти.
Слайд 15
Одноатомный спирт - этанол
Бесцветная жидкость с характерным запахом
и жгучим вкусом, температурой кипения78С. Легче воды. Смешивается с
ней в любых отношениях.Легко воспламеняется, горит слабо светящимся голубоватым пламенем.
Слайд 16
Применение этанола
Этиловый спирт употребляется при приготовлении различных
спиртных напитков.
В медицине для приготовления экстрактов из лекарственных
растений, а также для дезинфекции.В косметике и парфюмерии этанол — растворитель для духов и лосьонов.
Слайд 17
Вредное воздействие этанола
В начале опьянения страдают структуры
коры больших полушарий; активность центров мозга, управляющих поведением, подавляется:
утрачивается разумный контроль над поступками, снижается критическое отношение к себе. И. П. Павлов называл такое состояние «буйством подкорки».При очень большом содержании алкоголя в крови угнетается активность двигательных центров мозга, главным образом страдает функция мозжечка - человек полностью теряет ориентацию.
Слайд 18
Вредное воздействие этанола
Изменения структуры мозга, вызванные многолетней алкогольной
интоксикацией, почти необратимы, и даже после длительного воздержания от
употребления спиртных напитков они сохраняются. Если же человек не может остановиться, то органические и, следовательно, психические отклонения от нормы идут по нарастающей.
Слайд 19
Вредное воздействие этанола
Алкоголь крайне неблагоприятно влияет на сосуды
головного мозга. В начале опьянения они расширяются, кровоток в
них замедляется, что приводит к застойным явлениям в головном мозге. Затем, когда в крови помимо алкоголя начинают накапливаться вредные продукты его неполного распада, наступает резкий спазм, сужение сосудов, развиваются такие опасные осложнения, как мозговые инсульты, приводящие к тяжелой инвалидности и даже смерти.
Слайд 20
Многоатомный спирт -этиленгликоль
Этиленгликоль — представитель предельных двухатомных спиртов
— гликолей.
Название гликоли получили вследствие сладкого вкуса многих
представителей ряда (греч. «гликос» — сладкий). Этиленгликоль - сиропообразная жидкость сладкого вкуса, без запаха, ядовит. Хорошо смешивается с водой и спиртом, гигроскопичен.
Слайд 21
Применение этиленгликоля
Важным свойством этиленгликоля является способность понижать температуру
замерзания воды, от чего вещество нашло широкое применения как
компонент автомобильных антифризов и незамерзающих жидкостей.Он применяется для получения лавсана (ценного синтетического волокна).
Слайд 22
Этиленгликоль - яд
Дозы вызывающие смертельное отравление этиленгликолем
варьируются в широких пределах - от 100 до 600
мл. По данным ряда авторов смертельной дозой для человека является 50-150 мл. Смертность при поражении этиленгликолем очень высока и составляет более 60% всех случаев отравления.Механизм токсического действия этиленгликоля до настоящего времени изучен недостаточно. Этиленгликоль быстро всасывается (в том числе через поры кожи) и в течение нескольких часов циркулирует в крови в неизмененном виде, достигая максимальной концентрации через 2-5 часов. Затем его содержание в крови постепенно снижается, и он фиксируется в тканях.
Слайд 23
Многоатомный спирт - глицерин
Глицерин – трехатомный предельный спирт.
Бесцветная, вязкая, гигроскопичная, сладкая на вкус жидкость. Смешивается с
водой в любых отношениях , хороший растворитель. Реагирует с азотной кислотой с образованием нитроглицерина. С карбоновыми кислотами образует жиры и масла.
Слайд 24
Применение глицерина
Применяется в производстве взрывчатых веществ нитроглицерина.
При обработке
кожи.
Как компонент некоторых клеёв.
При производстве пластмасс глицерин
используют в качестве пластификатора.В производстве кондитерских изделий и напитков (как пищевая добавкаE422).