Слайд 2
Координационная теория А.Вернера
В 1893 г. швейцарским химиком-неоргаником
Альфредом Вернером (1866–1919) была сформулирована теория, позволившая понять строение
и некоторые свойства комплексных соединений и названная координационной теорией. Поэтому комплексные соединения часто называют координационными соединениями.
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными.
Слайд 3
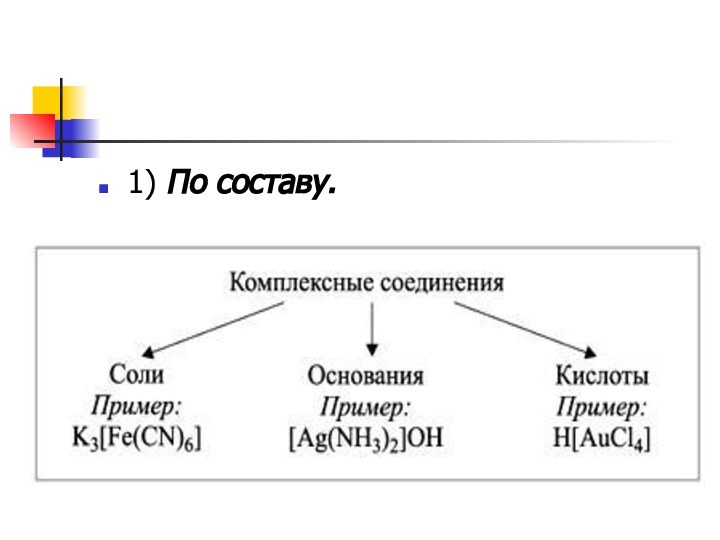
Состав.
Согласно теории Вернера центральное положение в
комплексных соединениях занимает, как правило, ион металла, который называют
центральным ионом, или комплексообразователем.
Слайд 4
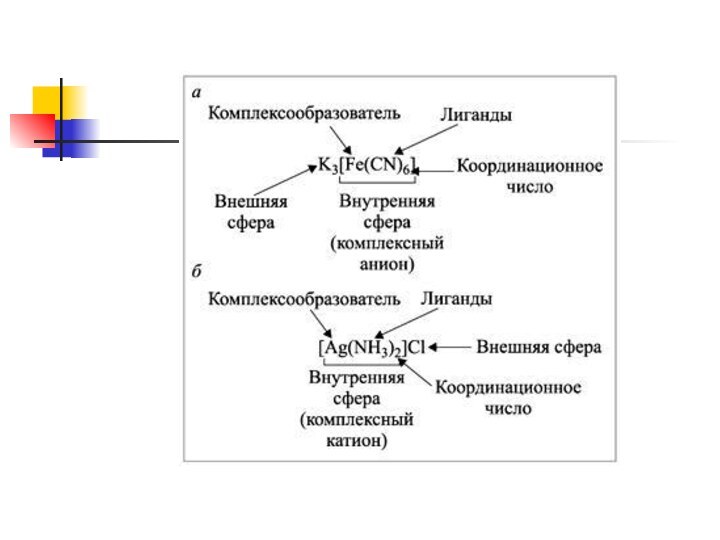
Комплексообразователь – частица (атом, ион или молекула), координирующая (располагающая) вокруг
себя другие ионы или молекулы.
Слайд 5
Комплексообразователь обычно имеет положительный заряд, является d-элементом, проявляет амфотерные
свойства, имеет координационное число 4 или 6. Вокруг комплексообразователя
располагаются (координируются) молекулы или кислотные остатки – лиганды (адденды).
Слайд 6
Лиганды – частицы (молекулы и ионы), координируемые комплексообразователем и имеющие
с ним непосредственно химические связи (например, ионы: Cl–, I–, NO3–,
OH–; нейтральные молекулы: NH3, H2O, CO).
Слайд 7
Лиганды не связаны друг с другом, так как
между ними действуют силы отталкивания. Когда лигандами являются молекулы,
между ними возможно молекулярное взаимодействие. Координация лигандов около комплексообразователя является характерной чертой комплексных соединений
Слайд 9
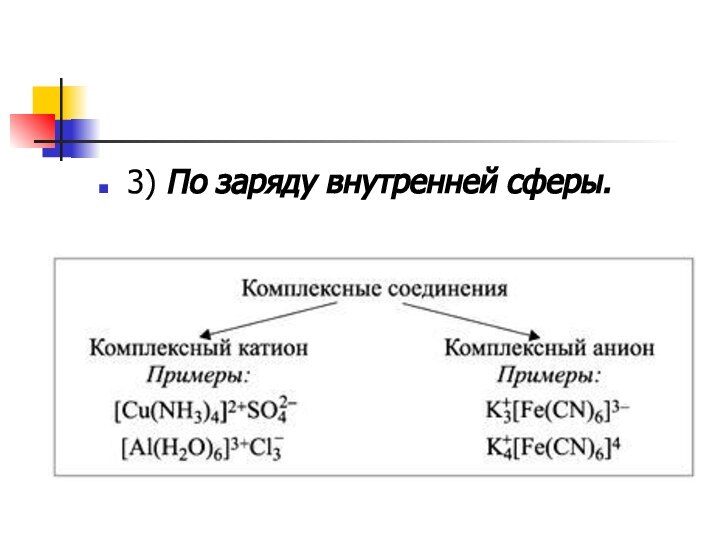
Классификация
Большое многообразие комплексных соединений и их свойств не
позволяет создать единую классификацию. Однако можно группировать вещества по
некоторым отдельным признакам.
Слайд 11
2) По типу координируемых лигандов.
а) Аквакомплексы – это комплексные катионы, в
которых лигандами являются молекулы H2O. Их образуют катионы металлов
со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз.
Примеры аквакомплексов:
[Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3.
Слайд 12
б)Гидроксокомплексы – это комплексные анионы, в которых лигандами являются
гидроксид-ионы OH–. Комплексообразователями являются металлы, склонные к проявлению амфотерных
свойств – Be, Zn, Al, Cr.
Например: Na[Al(OH)4], Ba[Zn(OH)4].
в) Аммиакаты – это комплексные катионы, в которых лигандами являются молекулы NH3. Комплексообразователями являются d-элементы.
Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
Слайд 13
г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются
анионы неорганических и органических кислот.
Например: K3[Al(C2O4)3], Na2[Zn(CN)4], K4[Fe(CN)6].
Слайд 15
Номенклатура комплексных соединений
Наибольшее распространение имеет номенклатура, рекомендованная
IUPAC. Название комплексного аниона начинается с обозначения состава внутренней сферы: число
лигандов обозначается греческими числительными: 2–ди, 3–три, 4–тетра, 5–пента, 6–гекса и т.д., далее следуют названия лигандов, к которым прибавляют соединительную гласную «о»: Cl– – хлоро-, CN– – циано-, OH– – гидроксо- и т.п.
Слайд 16
Если у комплексообразователя переменная степень окисления, то в
скобках римскими цифрами указывают его степень окисления, а его
название с суффиксом -ат: Zn – цинкат, Fe – феррат(III), Au – аурат(III). Последним называют катион внешней сферы в родительном падеже
Слайд 17
Примеры:
K3[Fe(CN)6] – гексацианоферрат(III) калия,
K4[Fe(CN)6] – гексацианоферрат(II) калия,
K2[Zn(OH)4] – тетрагидроксоцинкат калия.
Слайд 18
Например:
[Cu(NH3)4]SO4 – сульфат тетраамминмеди(II),
[Al(H2O)6]Cl3 – хлорид гексаакваалюминия.
Слайд 19
Химические свойства комплексных соединений
1. В растворе комплексные соединения
ведут себя как сильные электролиты, т.е. полностью диссоциируют на
катионы и анионы.
[Pt(NH3)4]Cl2 = Pt(NH3)4] 2+ + 2Cl –,
K2[PtCl4] = 2K+ + [PtCl4] 2–
Слайд 20
2. При действии сильных кислот происходит разрушение гидроксокомплексов
а)
при недостатке кислоты
Na3[Al(OH)6] + 3HCl = 3NaCl
+ Al(OH)3 + 3H2O;
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 + 6H2O.
Слайд 21
3. Нагревание (термолиз) всех аммиакатов приводит к их разложению,
например:
[Cu(NH3)4]SO4 = CuSO4 + 4NH3 .
Слайд 22
Значение комплексных соединений
Координационные соединения имеют исключительно большое
значение в природе. Достаточно сказать, что почти все ферменты,
многие гормоны, лекарства, биологически активные вещества представляют собой комплексные соединения. Например, гемоглобин крови, благодаря которому осуществляется перенос кислорода от легких к клеткам ткани, является комплексным соединением, содержащим железо, а хлорофилл, ответственный за фотосинтез в растениях, – комплексным соединением магния.
Слайд 23
Значительную часть природных минералов, в том числе полиметаллических
руд и силикатов, также составляют координационные соединения. Более того,
химические методы извлечения металлов из руд, в частности меди, вольфрама, серебра, алюминия, платины, железа, золота и других, также связаны с образованием легкорастворимых, легкоплавких или летучих комплексов. Например: Na3[AlF6] – криолит, KNa3[AlSiO4]4 – нефелин (минералы, комплексные соединения, содержащие алюминий).
Слайд 24
Современная химическая отрасль промышленности широко использует координационные соединения
как катализаторы при синтезе высокомолекулярных соединений, при химической переработке
нефти, в производстве кислот.
Слайд 25
Задания.
Письменно дать характеристику следующим комплексным соединениям по строению
и классифицировать по признакам:
K3[Cr(OH)6], [Cr(H2O)6](NO3)3, Na2[Zn(CN)4],
[Ag(NH3)2]OH.










![Комплексные соединения г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот.Например: K3[Al(C2O4)3], Na2[Zn(CN)4], K4[Fe(CN)6].](/img/tmb/12/1138918/8061410a77dd1072e97ccf57f346954d-720x.jpg)


![Комплексные соединения Примеры:K3[Fe(CN)6] – гексацианоферрат(III) калия,K4[Fe(CN)6] – гексацианоферрат(II) калия,K2[Zn(OH)4] – тетрагидроксоцинкат калия.](/img/tmb/12/1138918/a195f5e7a0dd0f8fcb3b244900cc6638-720x.jpg)
![Комплексные соединения Например:[Cu(NH3)4]SO4 – сульфат тетраамминмеди(II),[Al(H2O)6]Cl3 – хлорид гексаакваалюминия.](/img/tmb/12/1138918/e40f8040a5200ac3ff9fb3a383746f41-720x.jpg)


![Комплексные соединения 3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:[Cu(NH3)4]SO4 = CuSO4 + 4NH3 .](/img/tmb/12/1138918/4117d1839fc81b29352e0615ee1391b9-720x.jpg)